题目内容
18.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )| A. | 元素C、D、E的最高价氧化物对应的水化物之间两两都可以发生反应 | |
| B. | 1mol由元素A、B组成且含有18 mol e-的化合物只有一种 | |
| C. | 含D元素的盐溶液只能显酸性,不可能显碱性 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,B为C元素,元素D是地壳中含量最多的金属元素,D为Al元素,其中元素A、E的单质在常温下呈气态,则A为H,E为Cl,元素C在同周期的主族元素中原子半径最大,C为Na,以此来解答.
解答 解:由上述分析可知,A为H,B为C,C为Na,D为Al,E为Cl,
A.氢氧化铝具有两性,分别与NaOH、高氯酸反应生成盐和水,NaOH、高氯酸反应生成盐和水,故A正确;
B.1mol由元素A、B组成且含有18 mol e-的化合物有C2H6,只有一种,故B正确;
C.含D元素的盐溶液为氯化铝时显酸性,为偏铝酸钠时显碱性,故C错误;
D.化合物AE为HCl、CE为NaCl,含有化学键分别为共价键、离子键,故D错误;
故选AB.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
8.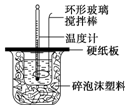 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸电离要吸收能量.
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g•℃),则该反应的中和热为△H=-56.06kJ/mol.根据计算结果,写出该中和反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.01kJ/mol.
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热偏小(填“偏大”、“偏小”或“不变”).
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是醋酸电离要吸收能量.
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
6. 纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
(1)工业上常用方法II和方法III制取Cu2O而很少用方法I,其原因是反应不易控制,易还原产生Cu.
(2)己知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(s)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=2c-a-bkJ•mol-1.
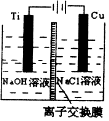
(3)方法II采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
下列叙述正确的是AC(填字母代号).
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10-5mol/(L•min)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=1.8×10-7mol/L.(体积变化忽略不计)若再向沉淀生成后的溶液中加入100mL0.001mol/L盐酸,是否继续产生沉淀否(填“是”或“否”).
 纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)己知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(s)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=2c-a-bkJ•mol-1.
(3)方法II采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
| 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10-5mol/(L•min)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10-10,则此时溶液中的c(Ag+)=1.8×10-7mol/L.(体积变化忽略不计)若再向沉淀生成后的溶液中加入100mL0.001mol/L盐酸,是否继续产生沉淀否(填“是”或“否”).
13.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数和核外电子数之差为( )
| A. | 175 | B. | 47 | C. | 118 | D. | 57 |
8.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 标准状况下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA | |
| B. | 28g乙烯和环丁烷的混合气体中含有的碳原子数为3NA | |
| C. | 0.5molNa2O2中含有NA个阴离子 | |
| D. | 1L0.1mol/LAl2(SO4)3溶液中含有的阳离子总数为0.2NA |
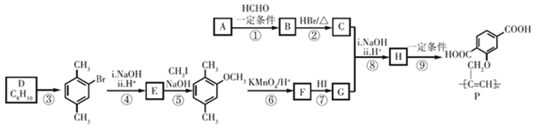
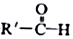 $\stackrel{一定条件}{→}$R-C≡
$\stackrel{一定条件}{→}$R-C≡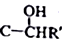
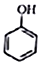 +CH2I$\stackrel{NaOH}{→}$
+CH2I$\stackrel{NaOH}{→}$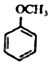 +NaI+H2O
+NaI+H2O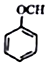 +HI→
+HI→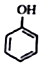 +CH2I
+CH2I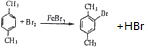 .
.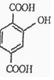 .
.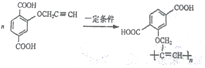 .
.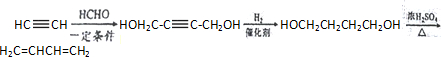 .
.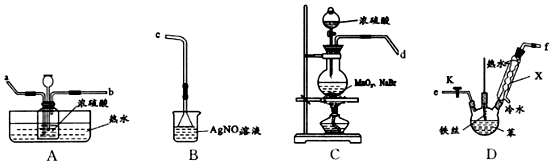
 ;仪器X的名称为球形冷凝管.
;仪器X的名称为球形冷凝管. ?
?
 ;
;