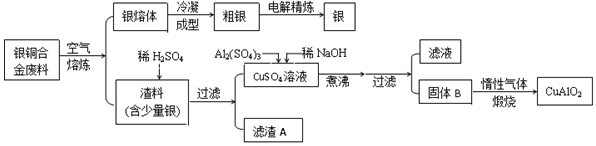
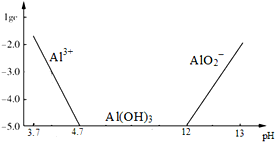
题目内容
7.甲醇作为一种燃料还可用于燃料电池.在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的负极反应式为CH3OH-6e-+3CO32-=4CO2↑+2H2O.分析 负极上CH3OH失电子结合碳酸根发生氧化反应生成二氧化碳和水.
解答 解:负极上CH3OH失电子结合碳酸根发生氧化反应生成二氧化碳和水,电极反应式为:CH3OH-6e-+3CO32-=4CO2↑+2H2O,
故答案为:CH3OH-6e-+3CO32-=4CO2↑+2H2O.
点评 本题考查了电极方程式的书写,侧重于考查学生对基础知识的应用能力,题目难度中等.

练习册系列答案
相关题目
18.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
| A. | 元素C、D、E的最高价氧化物对应的水化物之间两两都可以发生反应 | |
| B. | 1mol由元素A、B组成且含有18 mol e-的化合物只有一种 | |
| C. | 含D元素的盐溶液只能显酸性,不可能显碱性 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
2.分子式为C5H10O2且可NaHCO3溶液反应生成CO2的有机化合物有(不含立体异构)( )
| A. | 4种 | B. | 6种 | C. | 7种 | D. | 9种 |
12.能说明醋酸是弱电解质的事实是( )
| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 | |
| C. | 醋酸钠溶液呈一定的碱性 | |
| D. | 0.1mol/L的CH3COOH溶液中,氢离子浓度约为0.001mol/L |
19.向含有a mol NaOH和a mol Ba(OH)2的混合液中通入b mol CO2气体,充分反应后(忽略水解对离子浓度变化的影响),下列说法不正确的是( )
| A. | 当a=b时,发生的离子总反应为:2OH-+CO2+Ba2+═BaCO3↓+H2O | |
| B. | 当3a=2b时,发生的离子总反应为:6OH-+3CO2+2Ba2+═2BaCO3↓+3H2O+CO32- | |
| C. | 当$\frac{3}{2}$a<b<3a时,溶液中含有n(CO32-):n(HCO3-)=(3a-b):(2b-3a) | |
| D. | 当3a=b时,溶液中Na+、Ba2+与HCO3-的物质的量之比为1:1:3 |
16.已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得.
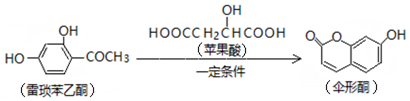
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 一分子雷琐苯乙酮含有3个碳碳双键 | |
| B. | 苹果酸的一种缩聚产物是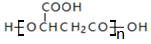 | |
| C. | 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH | |
| D. | 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应 |
17.25℃时,下列有关溶液中各微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L的NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol/L的CH3COONa:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 某FeCl3溶液pH=4:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) | |
| D. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)═c(H+)+c(Na+) |
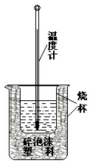 50ml 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: