题目内容
10.铁在自然界分别广泛,在工业、农业和国防科技中有重要应用.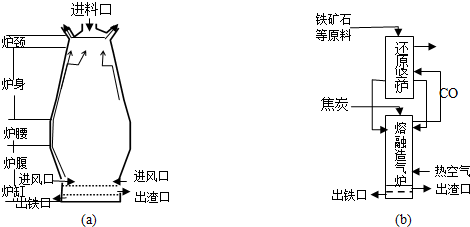
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示.原料中除铁矿石和焦炭外含有石灰石.除去铁矿石中脉石(主要成分为SiO2 )的化学反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;高炉排出气体的主要成分有N2、CO2和CO(填化学式).
(2)已知:①Fe2O3 (s)+3C(s)═2Fe(s)+3CO(g)△H=+494kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1
③C(s)+$\frac{1}{2}$O2(g)═CO (g)△H=-110kJ•mol-1
则反应Fe2O3 (s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2 (g) 的△H=-355kJ•mol-1.理论上反应②③放出的热量足以供给反应①所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的炉腰部分,主要反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;熔融造气炉相当于高炉的炉腹部分.
(4)铁矿石中常含有硫,使高炉气中混有SO2 污染空气,脱SO2 的方法是碱液或氢氧化钠、氨水.
分析 (1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙;加入焦炭,先生成CO,最后生成二氧化碳;
(2)利用盖斯定律将①+②×3得到Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)的△H,因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应.
解答 解:(1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙,涉及反应有CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3,加入焦炭,先生成CO,最后生成二氧化碳,尾气中含有CO,
故答案为:石灰石;CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;CO;
(2)利用盖斯定律将①+②×3得到Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)△H=(+494kJ•mol-1)+3×(-283kJ•mol-1)=-355kJ•mol-1,
因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应,
故答案为:-355;②③;①;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应,则熔融造气炉相当于高炉的炉腹部分,
故答案为:炉腰;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;炉腹;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应,可用碱液或氢氧化钠、氨水等吸收,
故答案为:碱液或氢氧化钠、氨水.
点评 本题为2015年海南考题,涉及高炉炼铁,侧重于化学与生产的考查,综合考查元素化合物知识,有利于培养学生良好的科学素养,难度中等.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| A. | $\frac{2}{5}$ mol | B. | $\frac{11}{5}$ mol | C. | $\frac{1}{5}$ mol | D. | $\frac{1}{3}$ mol |
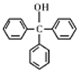 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.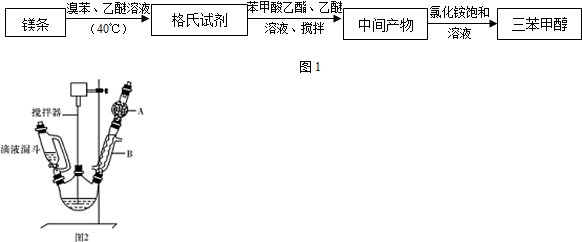
已知:(I)格氏试剂容易水解:
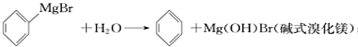
(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
请回答以下问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴加热方式.
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:

其中,洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
| A. | 由SiO2不能与水反应生成H2SiO3,可知SiO2不是H2SiO3的酸酐 | |
| B. | 由SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可知碳的非金属性大于硅 | |
| C. | CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3 | |
| D. | SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物 |
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
| A. | 阳极100g,阴极128g | B. | 阳极96.8g,阴极110.8g | ||
| C. | 阳极94.8g,阴极108.8g | D. | 阳极95.9g,阴极114.0g |
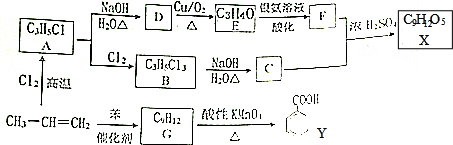
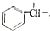 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$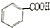
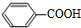 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$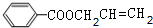 +H2O.
+H2O.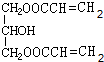 (任写一种即可).对于化合物X,下列说法正确的是AC.
(任写一种即可).对于化合物X,下列说法正确的是AC.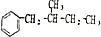 :则Z的同分异构体中,符合
:则Z的同分异构体中,符合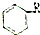 结构且有2个CH3的有3种(不包括Z).
结构且有2个CH3的有3种(不包括Z).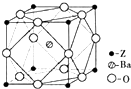 A、B、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
A、B、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知: