题目内容
15. A、B、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
A、B、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:①A为周期表中原子半径最小的元素;
②B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④A、B、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题:(答题时,A、B、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为平面三角形,其中心原子采取sp2杂化;化合物N的固态时的晶体类型为分子晶体.
(2)B、X、Y三种元素的第一电离能由小到大的顺序为C<O<N.
(3)由上述一种或多种元素组成的与BY2互为等电子体的分子为N2O(写分子式).
(4)由B、X、Y三种元素所组成的BXY-离子在酸性条件下可与NaClO反应,生成X2、BY2等物质.上述反应的离子方程式为2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O.
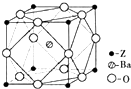
(5)Z原子基态时的外围电子排布式为3d24s2,Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个“Z”原子等距离且最近的氧原子数为6.
分析 A、B、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:①A为元素周期表中原子半径最小的元素,则A为H元素;②B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子排布为1s22s22p2,则B为C元素;③X的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,X为O元素;结合原子序数可知,X为N元素;④A、B、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,则M为HCHO,N为C6H6;⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同,原子序数为22,则Z为Ti元素,据此解答.
解答 解:A、B、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:①A为元素周期表中原子半径最小的元素,则A为H元素;②B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子排布为1s22s22p2,则B为C元素;③X的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,X为O元素;结合原子序数可知,X为N元素;④A、B、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,则M为HCHO,N为C6H6;⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同,原子序数为22,则Z为Ti元素.
(1)化合物M为HCHO,碳原子的孤电子对数为0,碳原子的σ键数为3,则碳原子采取sp2杂化,空间结构为平面三角形,化合物N为苯,由苯分子直接构成的,则N在固态时的晶体类型为分子晶体,
故答案为:平面三角形;sp2;分子晶体;
(2)B、X、Y三种元素的分别为C、N、O,同周期元素从左到右元素的第一电离能呈增大趋势,则C元素的最小,但N原子的电子排布中2p轨道为半满稳定状态,能量较低,则失去1个电子更难,第一电离能高于O元素,故第一电离能C<O<N,
故答案为:C<O<N;
(3)与CO2互为等电子体的分子为N2O,
故答案为:N2O;
(4)由C、N、O三种元素所组成的CNO-离子在酸性条件下可与NaClO反应,生成N2、CO2等物质.上述反应的离子方程式为:2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O,
故答案为:2CNO-+2H++3ClO-═N2↑+2CO2↑+3C1-+H2O;
(5)Z为Ti,核外电子数为22,原子基态时的电子排布式为:1s22s22p63s23p63d24s2,外围电子排布式为3d24s2,由晶体结构图可知,晶体内与每个Z原子等距离且最近的氧原子在棱的位置,关于Z原子对称,则氧原子数为3×2=6,
故答案为:3d24s2;6.
点评 本题是对物质结构的考查,涉及分子结构、杂化轨道、电离能、核外电子排布式、晶胞结构等,推断元素是解题关键,注意理解同周期元素中第一电离能发生异常情况,难度中等.

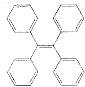 有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )
有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C26H22 | |
| B. | 该有机物属于苯的同系物 | |
| C. | 该有机物的一氯代物有4种 | |
| D. | 该有机物既可发生氧化反应,又可发生还原反应 |
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式BF3[SO3( g)、BBr3等].
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
C(s)+H2O(g)═CO(g)+H2(g)△H=bkJ•mol-1
H-H、O-H和O=O键的键能分别为436、462和495kJ•mol-1,则b为( )
| A. | +352 | B. | +132 | C. | -120 | D. | -330 |
| A. |  等质量锌粉与足量盐酸反应 | |
| B. | 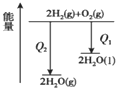 氢气与氧气反应中的能量变化 | |
| C. | 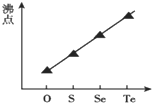 气态氢化物沸点 | |
| D. | 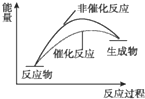 催化反应与非催化反应过程中的能量关系 |
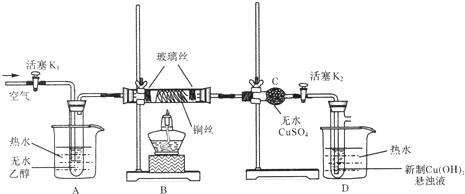
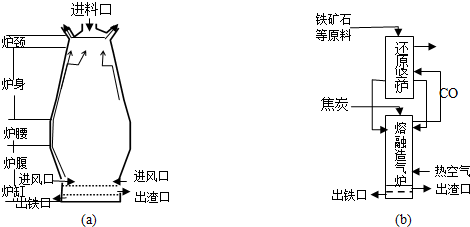
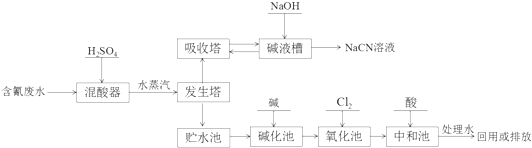
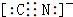 .
. 肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2•H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2•H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl