题目内容
20.下列物质转化在给定条件下能实现的是有( )①Si$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq)$\stackrel{CO_{2}}{→}$H2SiO3
②S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4
③Na$\stackrel{O_{2}}{→}$Na2O2 NaOH
④饱和NaCl(aq)$\stackrel{NH_{3}、CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3
⑤MgCl2(aq)$\stackrel{△}{→}$MgCl2•6H2O$→_{熔化}^{通电}$Mg
⑥Al2O3$→_{△}^{NaOH(aq)}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3
⑦Fe2O3 FeCl3(aq)$\stackrel{△}{→}$无水FeCl3
⑧CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{葡萄糖}$Cu2O.
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
分析 ①Si与NaOH溶液反应生成Na2SiO3溶液,再通二氧化碳生成硅酸沉淀;
②S点燃生成SO2,不生成SO3;
③Na在空气中燃烧生成Na2O2,再与水反应生成NaOH;
④饱和NaCl溶液中通入氨气和二氧化碳生成NaHCO3晶体,NaHCO3受热分解生成Na2CO3;
⑤MgCl2溶液加热得不到MgCl2•6H2O;
⑥Al2O3与NaOH溶液反应生成NaAlO2溶液,再通入足量的二氧化碳生成Al(OH)3;
⑦Fe2O3 与盐酸反应生成FeCl3溶液,加热蒸发得不到FeCl3;
⑧CuSO4溶液加NaOH生成Cu(OH)2,在加热条件下与葡萄糖反应生成Cu2O.
解答 解:①Si能溶于强碱溶液,Si与NaOH溶液反应生成Na2SiO3溶液,碳酸的酸性大于硅酸,Na2SiO3溶液通二氧化碳生成硅酸沉淀,物质转化在给定条件下能实现,故正确;
②S点燃生成SO2,不生成SO3,不能实现物质之间的转化,故错误;
③Na在空气中燃烧生成Na2O2,Na2O2再与水反应生成NaOH,物质转化在给定条件下能实现,故正确;
④饱和NaCl溶液中通入氨气和二氧化碳生成NaHCO3晶体,NaHCO3受热易分解,在加热条件下,NaHCO3分解生成Na2CO3,物质转化在给定条件下能实现,故正确;
⑤MgCl2在溶液中能发生水解,加热促进水解,而且生成的HCl易挥发,所以加热蒸干MgCl2溶液得不到MgCl2•6H2O,不能实现物质之间的转化,故错误;
⑥Al2O3与NaOH溶液反应生成NaAlO2溶液,NaAlO2与足量的二氧化碳生成Al(OH)3 和碳酸氢钠,所以物质转化在给定条件下能实现,故正确;
⑦Fe2O3 与盐酸反应生成FeCl3溶液,FeCl3在溶液中能发生水解,加热促进水解,而且生成的HCl易挥发,所以加热蒸干FeCl3溶液得不到FeCl3,不能实现物质之间的转化,故错误;
⑧CuSO4溶液加NaOH生成Cu(OH)2,在加热条件下新制的氢氧化铁悬浊液能与含有醛基的有机物发生反应生成Cu2O,所以Cu(OH)2与葡萄糖反应生成Cu2O,物质转化在给定条件下能实现,故正确.
故选B.
点评 本题考查化合物的性质,题目难度不大,熟练掌握物质的性质是解决此类问题的关键,正确运用物质分类及反应规律则是解决此类问题的有效方法.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案| A. | 加水稀释时溶液中各离子浓度均减小 | |
| B. | 加强酸弱酸强碱弱碱均抑制盐类的水解 | |
| C. | 正盐水溶液的pH均为7 | |
| D. | 酸式盐的pH均小于7 |
| A. | 明矾净水 | B. | 臭氧消毒餐具 | C. | 食醋清洗污垢 | D. | 工厂高压除尘 |
| A. | C9H10O2 | B. | C9H12O2 | C. | C9H16O2 | D. | C9H18O2 |
| A. | 食用油属于有机物,石蜡属于无机物 | |
| B. | 食用油属于纯净物,石蜡属于混合物 | |
| C. | 食用油属于酯类物质,石蜡属于烃类 | |
| D. | 食用油属于高分子化合物,石蜡属于小分子化合物 |
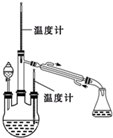 肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2•H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2•H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl