题目内容
如图1是部分短周期元素的常见化合价与原子序数的关系图:

(1)元素A的价电子排布式 .其同周期非金属元素(包括稀有气体)第一电离能由大到小的顺序是 .
(2)C2晶体中,其配位数为 .
(3)用电子式表示D2G的形成过程 .
(4)C、D、G离子半径大小顺序是 > > (用离子符号回答).
(5)某同学设计实验(见图2)证明A、B、F的非金属性强弱关系.
①溶液a和b分别为 .
②溶液c中的离子方程式为 .
(6)将0.5mol D2C2投入100mL 3mol/L ECl3溶液中用一个离子方程式表示该反应 .

(1)元素A的价电子排布式
(2)C2晶体中,其配位数为
(3)用电子式表示D2G的形成过程
(4)C、D、G离子半径大小顺序是
(5)某同学设计实验(见图2)证明A、B、F的非金属性强弱关系.
①溶液a和b分别为
②溶液c中的离子方程式为
(6)将0.5mol D2C2投入100mL 3mol/L ECl3溶液中用一个离子方程式表示该反应
考点:位置结构性质的相互关系应用,探究化学规律
专题:元素周期律与元素周期表专题
分析:由图中化合价可知,A、F的化合价都为+4、-4价,二者同主族,且F的原子序数较大,故A为C元素、故F为Si元素;
C的化合价为-2价,没有正化合价,故C为O元素;
D的化合价为+1价,处于ⅠA族,原子序数大于O元素,故D为Na元素;
E为+3价,原子序数大于Na,则E为Al元素;
G的最高正价为+6价、最低价为-2,应为S元素;B的有+5、-3价,处于ⅤA族,原子序数介于C、O之间,则B为N元素,
根据以上分析可知:A为C元素、B为N元素、C为O元素、D为Na元素、E为Al元素、F为Si元素、G为S元素.
C的化合价为-2价,没有正化合价,故C为O元素;
D的化合价为+1价,处于ⅠA族,原子序数大于O元素,故D为Na元素;
E为+3价,原子序数大于Na,则E为Al元素;
G的最高正价为+6价、最低价为-2,应为S元素;B的有+5、-3价,处于ⅤA族,原子序数介于C、O之间,则B为N元素,
根据以上分析可知:A为C元素、B为N元素、C为O元素、D为Na元素、E为Al元素、F为Si元素、G为S元素.
解答:
解:由图中化合价可知,A、F的化合价都为+4、-4价,二者同主族,且F的原子序数较大,故A为C元素、故F为Si元素;C的化合价为-2价,没有正化合价,故C为O元素;D的化合价为+1价,处于ⅠA族,原子序数大于O元素,故D为Na元素;E为+3价,原子序数大于Na,则E为Al元素;
G的最高正价为+6价、最低价为-2,应为S元素;B的有+5、-3价,处于ⅤA族,原子序数介于C、O之间,则B为N元素,
根据以上分析可知:A为C元素、B为N元素、C为O元素、D为Na元素、E为Al元素、F为Si元素、G为S元素,
(1)A为C元素,原子有2个电子层,价电子数为4,价电子排布为:2s22p2;
同周期非金属元素(包括稀有气体)有:Ne、F、N、O、C、B,同一周期中随着原子序数的递增,第一电离能逐渐增大,但是N原子的2p电子处于半满状态,比较稳定,其第一电离能大于O原子,所以第二周期非金属元素(包括稀有气体)第一电离能由大到小的顺序为:Ne F N O C B,
故答案为:2s22p2;Ne F N O C B;
(2)C为氧元素,氧气固态形成的晶体为分子晶体,与氧相邻的其他氧气分子有12个,所以其配位数为12,
故答案为:12;
(3)D为Na元素、G为S元素,Na2S属于离子化合物,含有离子键,用电子式表示形成过程为: ,
,
故答案为: ;
;
(4)C为O元素、D为Na元素、G为S元素,电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->O2->Na+,
故答案为:S2-;O2-;Na+;
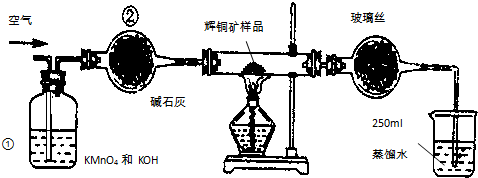
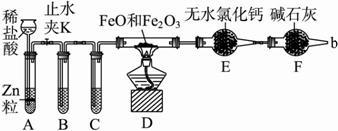
(5)由装置图可知,实验原理是利用强酸制备弱酸,硝酸易挥发,为防止干扰应除去,故锥形瓶中产生二氧化碳,应为硝酸与碳酸盐反应,溶液b吸收挥发的硝酸,应为饱和的碳酸氢钠,烧杯中应是二氧化碳与硅酸钠反应生成硅酸,
①由上述分析可知,溶液a为硝酸,溶液b为饱和NaHCO3溶液,
故答案为:硝酸、饱和NaHCO3溶液;
②溶液c中的离子方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-,
故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(6)将0.5mol Na2O2投入100mL 3mol/L AlCl3溶液中,生成1molNaOH、0.25mol氧气,AlCl3溶的物质的量为0.3mol,1:4<n(AlCl3):n(NaOH)=3:10<1:3,故反应生成Al(OH)3、AlO2-,溶液中溶质为偏铝酸钠、氯化钠,
根据电荷守恒可知反应中:n(AlO2-)=1mol-0.3mol×3=0.1mol,
根据Al元素守恒可知:n[Al(OH)3]=0.3mol-0.1mol=0.2mol,故n[Al(OH)3]:n(AlO2-):n(氧气)=0.2mol:0.1mol:0.25mol=4:2:5,反应离子方程式为:10Na2O2+6Al3++6H2O=4Al(OH)3+2AlO2-+5O2↑+20Na+,
故答案为:10Na2O2+6Al3++6H2O=4Al(OH)3+2AlO2-+5O2↑+20Na+.
G的最高正价为+6价、最低价为-2,应为S元素;B的有+5、-3价,处于ⅤA族,原子序数介于C、O之间,则B为N元素,
根据以上分析可知:A为C元素、B为N元素、C为O元素、D为Na元素、E为Al元素、F为Si元素、G为S元素,
(1)A为C元素,原子有2个电子层,价电子数为4,价电子排布为:2s22p2;
同周期非金属元素(包括稀有气体)有:Ne、F、N、O、C、B,同一周期中随着原子序数的递增,第一电离能逐渐增大,但是N原子的2p电子处于半满状态,比较稳定,其第一电离能大于O原子,所以第二周期非金属元素(包括稀有气体)第一电离能由大到小的顺序为:Ne F N O C B,
故答案为:2s22p2;Ne F N O C B;
(2)C为氧元素,氧气固态形成的晶体为分子晶体,与氧相邻的其他氧气分子有12个,所以其配位数为12,
故答案为:12;
(3)D为Na元素、G为S元素,Na2S属于离子化合物,含有离子键,用电子式表示形成过程为:
 ,
,故答案为:
 ;
;(4)C为O元素、D为Na元素、G为S元素,电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->O2->Na+,
故答案为:S2-;O2-;Na+;
(5)由装置图可知,实验原理是利用强酸制备弱酸,硝酸易挥发,为防止干扰应除去,故锥形瓶中产生二氧化碳,应为硝酸与碳酸盐反应,溶液b吸收挥发的硝酸,应为饱和的碳酸氢钠,烧杯中应是二氧化碳与硅酸钠反应生成硅酸,
①由上述分析可知,溶液a为硝酸,溶液b为饱和NaHCO3溶液,
故答案为:硝酸、饱和NaHCO3溶液;
②溶液c中的离子方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-,
故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(6)将0.5mol Na2O2投入100mL 3mol/L AlCl3溶液中,生成1molNaOH、0.25mol氧气,AlCl3溶的物质的量为0.3mol,1:4<n(AlCl3):n(NaOH)=3:10<1:3,故反应生成Al(OH)3、AlO2-,溶液中溶质为偏铝酸钠、氯化钠,
根据电荷守恒可知反应中:n(AlO2-)=1mol-0.3mol×3=0.1mol,
根据Al元素守恒可知:n[Al(OH)3]=0.3mol-0.1mol=0.2mol,故n[Al(OH)3]:n(AlO2-):n(氧气)=0.2mol:0.1mol:0.25mol=4:2:5,反应离子方程式为:10Na2O2+6Al3++6H2O=4Al(OH)3+2AlO2-+5O2↑+20Na+,
故答案为:10Na2O2+6Al3++6H2O=4Al(OH)3+2AlO2-+5O2↑+20Na+.
点评:本题考查结构性质位置关系、半径比较、电子式、化学实验、氧化还原反应计算、离子方程式的书写等,题目难度中等,(6)中离子方程式书写关键是确定氢氧化铝与偏铝酸钠的关系,也可以用方程式进行过量计算解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、物质的量浓度为0.5mol/L Mg Cl2溶液,含有Cl-离子数为NA |
| B、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| C、22.4L氖气所含有的原子数目为NA |
| D、常温常压下,14g N2含有分子数为NA |
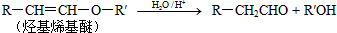

 .
.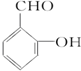 的属于芳香族化合物的两种官能团异构体的结构简式:
的属于芳香族化合物的两种官能团异构体的结构简式: )的一条路线如下
)的一条路线如下