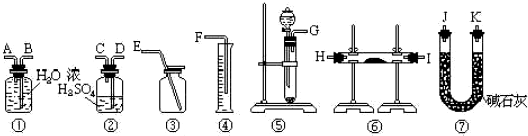
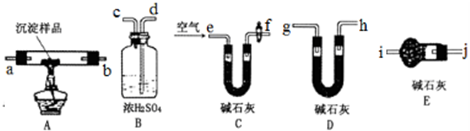
题目内容
A元素原子M电子层上有7个电子,B元素与A元素位于同一周期,B元素的原子最外电子层只有1个电子.
(1)写出元素符号:A ,B ;
(2)画出B元素的原子结构示意图 ;
(3)用电子式表示AB化合物的形成过程: .
(1)写出元素符号:A
(2)画出B元素的原子结构示意图
(3)用电子式表示AB化合物的形成过程:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A元素原子M电子层上有7个电子,说明其K层和L层已经排满,则A为氯元素;
B元素与A元素位于同一周期,则B元素位于第三周期,B元素的原子最外电子层只有1个电子,则B为Na元素,据此进行解答.
B元素与A元素位于同一周期,则B元素位于第三周期,B元素的原子最外电子层只有1个电子,则B为Na元素,据此进行解答.
解答:
解:(1)A元素原子M电子层上有7个电子,说明其K层和L层已经排满,则A为氯元素;B元素与A元素位于同一周期,则B元素位于第三周期,B元素的原子最外电子层只有1个电子,则B为Na元素,
根据分析可知,A为Cl、B为Na,
故答案为:Cl;Na;
(2)B为Na,钠原子的核电荷数为11,最外层电子式为1,其原子结构示意图为: ,
,
故答案为: ;
;
(3)A为氯元素最外层7个电子,为-1价、B为钠元素最外层一个电子为+1价,钠和氯形成的化合物为氯化钠,钠离子和氯离子通过离子键结合属于离子化合物NaCl,用电子式表示氯化钠的形成过程为: ,
,
故答案为: .
.
根据分析可知,A为Cl、B为Na,
故答案为:Cl;Na;
(2)B为Na,钠原子的核电荷数为11,最外层电子式为1,其原子结构示意图为:
 ,
,故答案为:
 ;
;(3)A为氯元素最外层7个电子,为-1价、B为钠元素最外层一个电子为+1价,钠和氯形成的化合物为氯化钠,钠离子和氯离子通过离子键结合属于离子化合物NaCl,用电子式表示氯化钠的形成过程为:
 ,
,故答案为:
 .
.
点评:本题考查了位置结构与性质的关系,题目难度中等,注意掌握元素周期表结构、元素周期律内容,明确原子结构与元素周期表、元素周期律之间的关系为解答关键.

练习册系列答案
相关题目
分子式为C9H12的所有带苯环结构的异构体中,在催化剂条件下与液溴发生取代反应,其一溴代物为三种的结构有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
把Ca(OH)2放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),加入以下固体,能使Ca(OH)2减少的是( )
| A、NaOH |
| B、Na2CO3 |
| C、CaCl2 |
| D、NaClO |
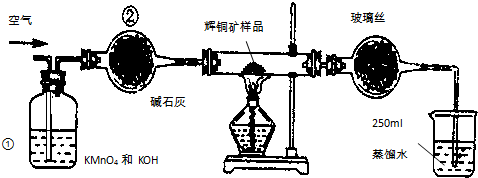
 测某种含有少量氧化钠的过氧化钠试样的质量分数.
测某种含有少量氧化钠的过氧化钠试样的质量分数.