题目内容
下列各组物质均属于电解质的是( )
| A、SO2、Cl2、氨水 |
| B、AgCl、Ba(OH)2、HClO |
| C、NaOH、HCl、NaCl |
| D、酒精、Cu、蔗糖 |
考点:电解质与非电解质
专题:物质的分类专题
分析:在水溶液或者熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不能导电的化合物为非电解质,无论电解质还是非电解质,都一定为化合物,据此进行解答.
解答:
A.二氧化硫为非电解质,氯气为单质,氨水为混合物,氯气和氨水既不是电解质,也不是非电解质,故A错误;
B.氯化银在熔融状态下能够导电,氢氧化钡在水溶液和熔融状态下能够导电,次氯酸在水溶液中能够电离出氢离子和次氯酸离子,所以AgCl、Ba(OH)2、HClO都是电解质,故B正确;
C.氢氧化钠和氯化钠为在水溶液和熔融状态下都能够导电的化合物,而氯化氢在水溶液中能够电离出氢离子和氯离子,所以NaOH、HCl、NaCl都是电解质,故C正确;
D.铜为单质,既不是电解质,也不是非电解质;酒精和蔗糖在水溶液和熔融状态下都不能导电,二者为非电解质,故D错误;
故选BC.
B.氯化银在熔融状态下能够导电,氢氧化钡在水溶液和熔融状态下能够导电,次氯酸在水溶液中能够电离出氢离子和次氯酸离子,所以AgCl、Ba(OH)2、HClO都是电解质,故B正确;
C.氢氧化钠和氯化钠为在水溶液和熔融状态下都能够导电的化合物,而氯化氢在水溶液中能够电离出氢离子和氯离子,所以NaOH、HCl、NaCl都是电解质,故C正确;
D.铜为单质,既不是电解质,也不是非电解质;酒精和蔗糖在水溶液和熔融状态下都不能导电,二者为非电解质,故D错误;
故选BC.
点评:本题考查了电解质与非电解质的判断,题目难度不大,注意掌握电解质与非电解质的概念及判断方法,明确单质和混合物既不是电解质,也不是非电解质.

练习册系列答案
相关题目
将一定量的锌与100mL 18.5mol/L浓硫酸充分反应,锌完全溶解,同时生成16.8L气体(标准状况),将反应后的溶液稀释到1L,测得溶液的c(H+)=1mol/L,则下列叙述中错误的是( )
| A、气体A为二氧化硫和氢气的混合物 |
| B、气体A中二氧化硫和氢气的体积比为4:1 |
| C、反应中共消耗锌95.5g |
| D、反应中共转移电子1.5mol |
X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z原子序数之和为40,X是短周期中除稀有气体元素外半径最大的元素.下列说法正确的是( )
| A、若X、Y、W形成的化合物为XYW2,则其水溶液可以显碱性 |
| B、Y的最高价氧化物对应的水化物一定是碱 |
| C、稳定性:W的氢化物>Z的氢化物,沸点:Z的氢化物>W的氢化物 |
| D、X、Y的氧化物晶体类型一定相同 |
下列说法中不正确的是( )
| A、煤、石油、天然气均为化石能源 |
| B、化石能源是可再生能源 |
| C、直接燃烧煤不如将煤进行深加工后再燃烧效果好 |
| D、化石燃料在燃烧过程中能产生污染环境的SO2等有害气体 |
下列叙述正确的是( )
| A、Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B、100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显碱性 |
| C、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| D、在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
 随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.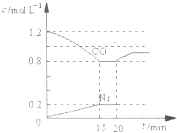 已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);
已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);