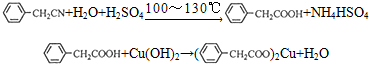题目内容
19.KI在食品、医药领域有广泛用途.某科研小组利用碘废弃液(主要含I2、I-)制备KI,流程如图1: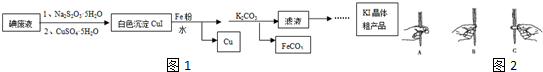
已知:I2+2S2O32-═S4O62-+2I-
(1)加入胆矾的作用氧化剂、富集碘元素.
(2)为制得KI晶体粗产品,滤液后续操作步骤是将滤液倒入蒸发皿中加热蒸发、冷却结晶,过滤、干燥得到KI晶体粗产品
(3)用沉淀滴定法测定样品中KI含量的实验步骤如下:
a.称取3.000g样品,溶解,配制成250mL溶液
b.量取25.00mL待测液于锥形瓶中;
c.用0.1000mol•L-1AgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液16.50mL
①配制250mL样品溶液时,所需的仪器除烧杯、玻璃棒之外,还缺少的玻璃仪器是250ml容量瓶 胶头滴管.
②AgNO3标准溶液在使用之前通常要重新标定,原因是硝酸银不稳定,见光易分解,放置之后的硝酸银溶液的浓度会发生变化,对滴定结果造成影响;本实验滴定过程中操作滴定管的如图2示正确的是A(填编号).
③该样品中KI的质量百分数为91.30%.
④下列因素会导致KI含量的测定结果偏高的是C.
A.配制样品溶液定容时仰视 B.锥形瓶未干燥
C.滴定管未用AgNO3标准溶液润洗 D.滴定终点时滴定管尖嘴中产生气泡.
分析 (1)由流程图可知硫酸铜被还原成碘化亚铜沉淀,从而富集碘元素;
(2)从溶液中得到溶质,通常采取蒸发、浓缩、冷却结晶、过滤、干燥方法;
(3)①根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
②根据硝酸银不稳定,见光易分解;根据酸式滴定管的使用方法;
③根据关系式:AgNO3~KI来计算出碘化钾的质量,从而求出含量;
根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)由流程图可知硫酸铜被还原成碘化亚铜沉淀,硫酸铜晶体作氧化剂,富集碘元素;故答案为:氧化剂、富集碘元素;
(2)为制得KI晶体粗产品,将滤液倒入蒸发皿中加热蒸发、冷却结晶,过滤、干燥得到KI晶体粗产品,
故答案为:将滤液倒入蒸发皿中加热蒸发、冷却结晶,过滤、干燥得到KI晶体粗产品;
(3)①实验室要250mL待测溶液,用天平和药匙称取3.000g样品,在烧杯中溶解(可用量筒量取水),冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,所需的仪器除烧杯、玻璃棒之外,还缺少的玻璃仪器是有250ml容量瓶、胶头滴管;
故答案为:250ml容量瓶、胶头滴管;
②硝酸银不稳定,见光易分解,放置之后的硝酸银溶液的浓度会发生变化,对滴定结果造成影响,需要重新标定;使用酸式滴定管时,左手握滴定管,其无名指和小指向手心弯曲,轻轻地贴着出口部分,用其余三指控制活塞的转动;
故答案为:硝酸银不稳定,见光易分解,放置之后的硝酸银溶液的浓度会发生变化;A;
③滴定消耗的AgNO3的物质的量为0.1000mol•L-1×0.01650L=0.001650mol,由关系式AgNO3~KI可知25.00mL待测液中含有0.001650molKI,250mL溶液中含有0.01650molKI,即0.01650mol×166g/mol=2.739g,该样品中KI的质量百分数为$\frac{2.739g}{3.000g}$×100%=91.30%;
故答案为:91.30%;
④A.配制样品溶液定容时仰视,V偏大,溶液浓度偏低,故A错误;
B.锥形瓶未干燥,待测液的物质的量不变,测定结果不变,故B错误;
C.滴定管未用AgNO3标准溶液润洗,溶液被稀释,导致V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,KI的质量偏大,含量也偏大,故C正确;
D.滴定终点时滴定管尖嘴中产生气泡,导致V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,KI的质量偏小,含量也偏小,故D错误;
故选:C.
点评 本题考查了物质的制备与组成含量测定等,涉及滴定操作、滴定应用与计算等,难度中等,注意滴定中经常根据关系式进行计算,掌握根据关系式计算方法.

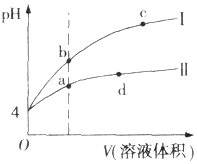 常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | pH=4的HCl溶液中H2O电离出的c(H+)=10-4 mol.L-1 | |
| B. | 曲线I为CH3COOH溶液的稀释曲线 | |
| C. | a、d点溶液和NaOH溶液完全反应时消耗的NaOH的物质的量相等 | |
| D. | a、b、c三点溶液中Kw:c=b<a |
| A. | 10g H2 和10g O2 | B. | 5.6L N2(标准状况)和11g CO2 | ||
| C. | 9g H2O 和0.5mol Br2D | D. | 224mLH2 (标准状况)和0.01mol N2 |
| 银盐 性质 | AgCl | AgBr | Ag2CrO4 |
| 颜色 | 白 | 浅黄 | 砖红 |
| A. | 配制NaOH标准液时,所用的NaOH固体中含有少量的KOH杂质 | |
| B. | 滴定前对碱式滴定管仰视读数,滴定后又俯视 | |
| C. | 滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失 | |
| D. | 碱式滴定管用蒸馏水洗净后,直接装入标准NaOH溶液 |
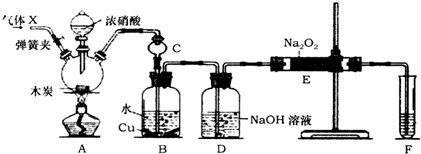
已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+.
具体操作:如图连接装置,检验气密性后,装入药品.实验开始前先通入常见气体X一段时间,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡,直至E中淡黄色粉末完全变为白色固体.
(1)气体X的化学式为N2,其作用是排尽系统内空气,以免生成的一氧化氮被空气中的氧气氧化.
(2)上述装置中,仪器C的作用是防止B中溶液倒吸.B中观察到的主要现象是铜片减小、溶液变蓝色、有气泡冒出.
(3)该活动小组制取的NaNO2产品不纯,杂质为NaOH(填化学式);为提高产品的纯度,对上述实验装置进行的改进是装置DE之间和装置EF之间添加干燥装置.
(4)请设计实验证明产品中含有NO2-取少量E中白色固体加入稀盐酸产生无色气体,遇到空气变化为红棕色证明固体中含有亚硝酸根离子(简述实验操作、现象和结论).
(5)称取该小组产品4.5g溶于水配成500mL溶液,取50mL溶液于锥形瓶中,用0.1000mol•L-1的酸性KMnO4溶液进行滴定,实验数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.80 | 20.01 | 20.00 | 19.99 |
a.酸式滴定管未用标准液润洗
b.锥形瓶用水洗净后又用待测液润洗
c.滴定前仰视读数,滴定终点平视读数
d.滴定结束后滴定管尖嘴处仍悬有液滴
根据表中数据,计算产品中亚硝酸钠的质量分数76.7%.
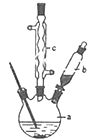 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线: