题目内容
14.某化学课外小组为测定空气中CO2的含量,进行了如下实验:①配制0.1000mol/L和0.01000mol/L的标准盐酸.
②用0.1000mol/L的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00mL,结果用去盐酸19.60mL.
③用测定的Ba(OH)2溶液吸收定量空气中的CO2.取Ba(OH)2溶液10.00mL,放入100mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10L标准状况下的空气,振荡,这时生成沉淀.
④过滤上述所得浊液.
⑤取滤液20.00mL,用0.01000mol/L的盐酸滴定,用去盐酸34.80mL.
请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?B、C、D、E、F、G;
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒
E.烧杯 F.胶头滴管 G.玻璃棒
(2)滴定操作中,左手控制活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化;
(3)Ba(OH)2溶液的物质的量浓度是0.0980mol/L;
(4)过滤所得浊液的目的是分离出BaCO3,防止HCl与BaCO3反应;
(5)此空气样品中含CO2的体积分数为0.025%;
(6)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果偏大(填“偏大”“偏小”或“无影响”).
分析 (1)\配制一定物质的量浓度的溶液的配制步骤选择仪器,配制一定物质的量浓度的盐酸时,步骤有计算、量取、稀释、转移、洗涤、定容、摇匀等:
(2)滴定操作时,左手控制活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化;
(3)反应方程式定量关系及滴定数据进行计算,根据反应方程式:Ba(OH)2+2HCl═BaCl2+2H2O,氢氧化钡物质的量等于氯化氢物质的量的$\frac{1}{2}$;
(4)分离出碳酸钡,防止碳酸钡与盐酸反应,影响滴定结果;
(5)求出二氧化碳反应后剩余的Ba(OH)2,根据Ba(OH)2的物质的量计算出空气中CO2的物质的量及体积分数;
(6)第二次滴定时,酸式滴定管没有润洗,导致标准液盐酸的浓度偏低,消耗的盐酸的体积偏小,计算出的剩余的氢氧化钡物质的量偏小.
解答 解:(1)配制一定物质的量浓度的盐酸时,步骤有减少、稀释、转移、洗涤、定容、摇匀等,需要仪器有:容量瓶、量筒(或者酸式滴定管)、烧杯、胶头滴管及玻璃棒,即BCDEFG,
故答案为:BCDEFG;
(2)滴定操作时,左手控制活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化,
故答案为:控制活塞; 摇动锥形瓶;注视锥形瓶内溶液颜色的变化;
(3)根据反应方程式:Ba(OH)2+2HCl═BaCl2+2H2O,则c[Ba(OH)2]×10.00 mL=$\frac{1}{2}$×0.1 mol/L×19.60 mL,解得c[Ba(OH)2]=0.0980 mol/L,
故答案为:0.0980 mol/L;
(4)下一步需要用盐酸滴定与二氧化碳反应后剩余的氢氧化钡,为了防止BaCO3与HCl发生反应,影响滴定结果,应该分离出BaCO3,
故答案为:分离出BaCO3,防止HCl与BaCO3反应;
(5)发生的反应方程式:Ba(OH)2+CO2═BaCO3↓+H2O,20 mL滤液中Ba(OH)2的物质的量为34.80×10-3×0.01×$\frac{1}{2}$mol=0.174×10-3 mol,那么100 mL滤液中有Ba(OH)2:100mL滤液中含有的氢氧化钡的物质的量为:0.174×10-3×$\frac{100ml}{20ml}$mol=8.70×10-4 mol,
原有的氢氧化钡的物质的量为:0.098 mol/L×10×10-3L=9.8×10-4 mol,
空气中二氧化碳消耗的氢氧化钡的物质的量为:9.8×10-4 mol-8.70×10-4 mol=1.1×10-4 mol,n(CO2)=n(Ba(OH)2)=1.1×10-4 mol,
二氧化碳的体积分数为:$\frac{1.1×1{0}^{-4}×22.4}{10}$×100%=0.025%,
故答案为:0.025%;
(6)由于酸式滴定管没有润洗,导致第二次滴定消耗的标准液盐酸体积偏小,计算出的氢氧化钡物质的量偏小,则与二氧化碳反应的氢氧化钡物质的量偏大,计算结果偏大,
故答案为:偏大.
点评 本题考查了测定空气中CO2的含量,涉及了配制溶液的仪器选择、体积分数的计算、实验基本操作等知识,充分考查了学生的分析、理解能力及对所学知识的掌握情况,题目难度中等.

| A. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| B. | 硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| C. | 硫酸溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4 | |
| D. | 硝酸银溶液与氯化钠溶液反应:Ag++Cl-═AgCl↓ |
| A. | 用碱式滴定管准确量取20.00 mL的高锰酸钾溶液 | |
| B. | 用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 | |
| C. | 用NaOH滴定盐酸时,只能用酚酞作指示剂 | |
| D. | 用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
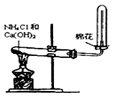
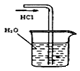
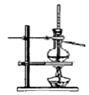
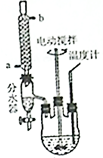 某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下:
某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下: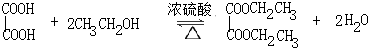 .
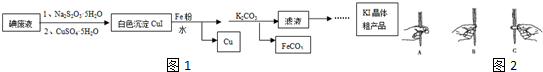
.
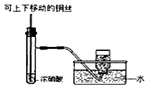
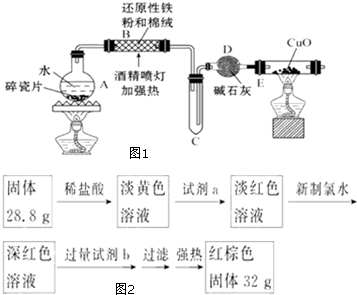 某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题: