题目内容
11.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温常压下,4.6g NO2或N2O4气体中所含原子总数均为0.3NA | |
| B. | 标准状况下,22.4 mL Br2所含的分子数为0.001NA | |
| C. | 标准状况下,22.4L的Cl2与1mol Fe充分反应,转移的电子数为3NA | |
| D. | 100 mL 0.1 mol•L-1的H2SO3溶液中,电离出的H+总数为0.02 NA |
分析 A、NO2或N2O4的最简式均为NO2;
B、标况下溴为液体;
C、标况下22.4L氯气即1mol氯气和1mol铁反应,铁过量;
D、亚硫酸为弱酸.
解答 解:A、NO2或N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为n=$\frac{4.6g}{46g/mol}$=0.1mol,故含0.3NA个原子,故A正确;
B、标况下溴为液体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、标况下22.4L氯气即1mol氯气和1mol铁反应,铁过量,而由于反应后氯元素为-1价,故1mol氯气转移2mol电子,即2NA个,故C错误;
D、亚硫酸为弱酸,故不能完全电离,则电离出的氢离子的个数小于0.02NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
1.分子式为C5H12O的所有醇中,被氧化后可产生饱和一元醛最多有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
2.Na2CO3固体中可能含有杂质K2CO3、NaHCO3、NaCl中的一种或几种,取10.6g样品,加入足量的稀盐酸产生气体4.4g,下列分析正确的是( )
| A. | 一定含有NaHCO3 | B. | 一定含有K2CO3 | C. | 可能含有NaHCO3 | D. | 一定含有NaCl |
16. CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5kJ热量.该反应的热化学方程式为CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206KJ/mol.
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g).测得CH4和H2的物质的量浓度随时间变化如下表所示:
①该反应第一次达平衡时的平衡常数K=0.135.
②3min时改变的反应条件是升高温度或增大H2O(g)的浓度或减小CO的浓度(只填一种条件的改变即可).
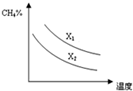
(3)已知一定压强下,温度、投料比X[$\frac{n(C{H}_{4})}{n({H}_{2}O)}$]对该反应的影响如图所示.图中的两条曲线所示投料比的关系X1>X2(填“=”、“>”或“<”).
 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5kJ热量.该反应的热化学方程式为CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206KJ/mol.
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g).测得CH4和H2的物质的量浓度随时间变化如下表所示:
| 浓度(mol/L) 物质 时间/min | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
| H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
②3min时改变的反应条件是升高温度或增大H2O(g)的浓度或减小CO的浓度(只填一种条件的改变即可).
(3)已知一定压强下,温度、投料比X[$\frac{n(C{H}_{4})}{n({H}_{2}O)}$]对该反应的影响如图所示.图中的两条曲线所示投料比的关系X1>X2(填“=”、“>”或“<”).
20.一定条件下,可逆反应的平衡常数可以用平衡浓度计算.也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
| A. | 对于C2H4(g)+H2O(g)═C2H5OH(g)在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为l mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)═2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol.若此时A、B和C均增加1 mol,平衡正向移动 | |
| C. | 一恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)═2NH3(g)达到平衡状态时,N2、H2、NH3各l mol,若此时再充入3mol N2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
1.元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为( )
| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | XY |
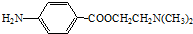 )可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):
)可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):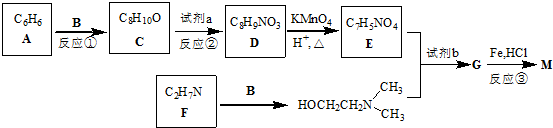
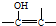 的结构不稳定.
的结构不稳定.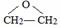 FH3C-NH-CH3
FH3C-NH-CH3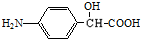 .
. .
.