题目内容
2.Na2CO3固体中可能含有杂质K2CO3、NaHCO3、NaCl中的一种或几种,取10.6g样品,加入足量的稀盐酸产生气体4.4g,下列分析正确的是( )| A. | 一定含有NaHCO3 | B. | 一定含有K2CO3 | C. | 可能含有NaHCO3 | D. | 一定含有NaCl |
分析 n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,则$\overline{M}$=$\frac{10.6g}{0.1mol}$=M(Na2CO3)=106g/mol,又M(K2CO3)>M(Na2CO3)>M(NaHCO3),因NaCl与盐酸不反应,且K2CO3的相对分子质量大于碳酸钠,则一定含有NaHCO3,以此解答该题.
解答 解:n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,则$\overline{M}$=$\frac{10.6g}{0.1mol}$=M(Na2CO3)=106g/mol,又M(K2CO3)>M(Na2CO3)>M(NaHCO3),
因NaCl与盐酸不反应,则实际与盐酸反应的碳酸钠质量小于10.6g,如$\overline{M}$仍等于106g/mol,则杂质的相对分子质量小于碳酸钠,则一定含有NaHCO3,K2CO3、NaCl至少含有一种,
故选A.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,注意把握物质的相对分子质量的关系,梳理做题思路,难度不大.

练习册系列答案
相关题目
7.根据元素在周期表中的位置可以预测( )
| A. | 分解温度:CH4>H2S | B. | 氧化性:NaClO>Na2SO3 | ||
| C. | 同浓度溶液pH:Na2SiO3>Na2CO3 | D. | 金属性:Ca>Na |
14.海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法错误的是( )
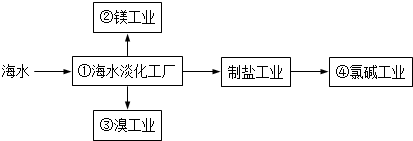

| A. | ①中可采用蒸馏法 | B. | ②中可通过电解法制金属镁 | ||
| C. | ③中提溴涉及到复分解反应 | D. | ④的产品可生产盐酸、漂白液等 |
11.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,4.6g NO2或N2O4气体中所含原子总数均为0.3NA | |
| B. | 标准状况下,22.4 mL Br2所含的分子数为0.001NA | |
| C. | 标准状况下,22.4L的Cl2与1mol Fe充分反应,转移的电子数为3NA | |
| D. | 100 mL 0.1 mol•L-1的H2SO3溶液中,电离出的H+总数为0.02 NA |
12.下列实验方案能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 除去乙烷中少量乙烯 | 将混合气体通入酸性高锰酸钾溶液 |
| B | 检验乙醇和乙酸溶液 | 分别在乙醇和乙酸中加入氢氧化钠溶液 |
| C | 制备少量氯化氢气体 | 向浓硫酸中滴加浓盐酸 |
| D | 证明Fe 3+的氧化性比Cu2+强 | 在氯化铜溶液中加入铁粉、振荡 |
| A. | A | B. | B | C. | C | D. | D |
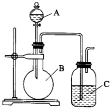 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.