题目内容
7.实验室有一瓶长久放置的亚硫酸钠,为了检验此瓶亚硫酸钠是否部分被氧化及测定亚硫酸钠的质量分数,有学生设计了下面实验,根据实验步骤填写下列空格.
(l)加入过量的A的理由是使 SO32-、SO42- 沉淀完全;检验A是否过量的方法是取上层清液少量,再加BaCl2溶液少量,若无沉淀生成,证明所加BaCl2溶液已过量或取上层清液少量,再加入Na2SO4溶液少量,若有沉淀生成,证明所加BaCl2溶液已过量.
(2)加入B稍过量的理由是使BaSO3 全部溶解;加入B发生反应的离子方程式是BaSO3+2H+=Ba2++SO2↑+H2O.
(3)怎样检验沉淀(Ⅲ)是否洗涤干净,取最后一次洗涤液少量,加入用稀HNO3酸化的AgNO3溶液,若无沉淀产生,表示沉淀已经洗净.
(4)亚硫酸钠的质量分数为(用含W1和W2的式子表示)(1-$\frac{{w}_{2}}{{w}_{1}}$×$\frac{142}{233}$)×100%.
分析 称取样品W1g加入水溶解得到无色溶液,加入过量A溶液为BaCl2溶液,得到硫酸钡沉淀、亚硫酸钡沉淀,过滤洗涤得到滤液Ⅰ和白色沉淀Ⅱ,加入过量B溶液为是溶液使亚硫酸钠溶解,过滤得到滤液Ⅱ和沉淀Ⅲ为硫酸钡沉淀,用蒸馏水洗涤多次烘干得到纯净固体W2g,
(1)加入过量A溶液使为了沉淀完全硫酸根离子和亚硫酸根离子;检验A是否过量,可以取上层清液加入氯化钡观察是否有沉淀生成设计;
(2)分析可知B为盐酸溶液,过量是为了全部溶解亚硫酸钡沉淀;
(3)检验沉淀(Ⅲ)是否洗涤干净应取最后一次洗涤液加入硝酸酸化的硝酸银检验是否含氯离子或检验是否含硫酸根离子设计检验方法;
(4)W1为Na2SO3和Na2SO4质量,W2为BaSO4质量,计算硫酸钡物质的量得到样品中硫酸钠物质的量,计算得到质量,用样品质量减去硫酸钠质量为亚硫酸钠质量,得到亚硫酸钠的质量分数;
解答 解:称取样品W1g加入水溶解得到无色溶液,加入过量A溶液为BaCl2溶液,得到硫酸钡沉淀、亚硫酸钡沉淀,过滤洗涤得到滤液Ⅰ和白色沉淀Ⅱ,加入过量B溶液为是溶液使亚硫酸钠溶解,过滤得到滤液Ⅱ和沉淀Ⅲ为硫酸钡沉淀,用蒸馏水洗涤多次烘干得到纯净固体W2g,
(1)加入过量A为BaCl2溶液使为了使 SO32-、SO42- 沉淀完全,检验BaCl2是否过量的方法是取上层清液少量,再加BaCl2溶液少量,若无沉淀生成,证明所加BaCl2溶液已过量或取上层清液少量,再加入Na2SO4溶液少量,若有沉淀生成,证明所加BaCl2溶液已过量,
故答案为:使 SO32-、SO42- 沉淀完全,取上层清液少量,再加BaCl2溶液少量,若无沉淀生成,证明所加BaCl2溶液已过量或取上层清液少量,再加入Na2SO4溶液少量,若有沉淀生成,证明所加BaCl2溶液已过量;
(2)加入B为盐酸稍过量的理由是把亚硫酸钡沉淀全部溶解,加入B发生反应的离子方程式是 BaSO3+2H+=Ba2++SO2↑+H2O,
故答案为:使BaSO3 全部溶解,BaSO3+2H+=Ba2++SO2↑+H2O;
(3)检验沉淀(Ⅲ)是否洗涤干净应取最后一次洗涤液加入硝酸酸化的硝酸银检验是否含氯离子或检验是否含硫酸根离子设计检验方法,步骤为:取最后一次洗涤液少量,加入用稀HNO3酸化的AgNO3溶液,若无沉淀产生,表示沉淀已经洗净,
故答案为:取最后一次洗涤液少量,加入用稀HNO3酸化的AgNO3溶液,若无沉淀产生,表示沉淀已经洗净;
(4)W1为Na2SO3和Na2SO4质量,W2为BaSO4质量,n(BaSO4)=n(Na2SO4)=$\frac{{W}_{2}}{233}$mol,用样品质量减去硫酸钠质量为亚硫酸钠质量,得到亚硫酸钠的质量分数=$\frac{{W}_{1}-\frac{{W}_{2}}{233}×142}{{W}_{1}}$×100%=(1-$\frac{{w}_{2}}{{w}_{1}}$×$\frac{142}{233}$)×100%,
故答案为:(1-$\frac{{w}_{2}}{{w}_{1}}$×$\frac{142}{233}$)×100%;
点评 本题看出来了物质组成和含量的测定实验过程分析判断,主要是物质性质,物质分离等知识点,主要是实验过程的理解和计算应用,题目难度中等.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案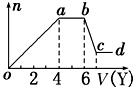 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是AlO2-、SiO32-,ab段发生反应的离子是CO32-,bc段发生反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(2)若Y是NaOH溶液,则X中一定含有的阳离子是Al3+、Mg2+、NH4+,其物质的量之比为2:1:4,ab段反应的离子方程式为NH4++OH-═NH3•H2O.
| A. | 向硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| D. | 向NaHCO3溶液中加入足量Ba(OH)2的溶液:Ba2++2HCO3-+2OH-=2H2O+BaCO3↓+CO32- |
| A. | 锂是较轻的金属 | B. | LiOH的碱性比NaOH弱 | ||
| C. | 锂的化学性质比钠活泼 | D. | 锂在空气中燃烧生成Li2O |
| A. | 该元素基态原子核外共有7种运动状态不同的电子 | |
| B. | 该元素位于周期表的S 区,属于金属元素 | |
| C. | 该元素在周期表中的位置第四周期第VA族 | |
| D. | 该元素M层含有11个电子 |
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3molH-H键断裂,同时6molN-H键断裂 | |
| C. | n(N2):n(H2):(NH3)=1:3:2 | |
| D. | 混合气体的密度不再改变 |
 盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下: .
.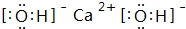 ,C的最高价氧化物的水化物化学式为:Al(OH)3.
,C的最高价氧化物的水化物化学式为:Al(OH)3.