题目内容
15.有A、B、C、D四种元素,已知A元素原子的K层和M层电子数相同;B元素原子的L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子层结构;D元素的原子核外有4个电子层,K层与L层电子数之和等于M层与N层电子数之和.依信息完成下列有关问题.
①A为:Mg[填元素符号].
②C的阳离子电子式为:Al3+;溶液中D元素的结构示意图
 .
.③D的最高价氧化物的水化物电子式为:
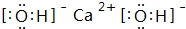 ,C的最高价氧化物的水化物化学式为:Al(OH)3.
,C的最高价氧化物的水化物化学式为:Al(OH)3.④B的气态氢化物的结构式为H-F;
⑤工业上通常用电解的方法获得单质C,但不是电解其氯化物.其主要原因是:氯化铝为共价化合物,熔化时不导电,工业上获得C的化学方程式:2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
分析 A元素原子的K层和M层电子数相同,说明原子核外有3个电子层,最外侧电子数为2,应为Mg,B元素原子的L层比K层电子数多5个,原子核外各层电子分别为2、7,应为F元素,C元素的+3价阳离子和氖原子具有相同的电子数,应为Al元素,D元素的原子核外有4个电子层,K层与L层电子数之和等于M层与N层电子数之和,说明原子核外各层电子数分别为2、8、8、2,应为Ca元素,结合题目分析解答.
解答 解:A元素原子的K层和M层电子数相同,说明原子核外有3个电子层,最外侧电子数为2,应为Mg,B元素原子的L层比K层电子数多5个,原子核外各层电子分别为2、7,应为F元素,C元素的+3价阳离子和氖原子具有相同的电子数,应为Al元素,D元素的原子核外有4个电子层,K层与L层电子数之和等于M层与N层电子数之和,说明原子核外各层电子数分别为2、8、8、2,应为Ca元素,
①通过以上分析知,A为Mg,故答案为:Mg;
②C为Al元素,C的阳离子电子式为:Al3+,D是Ca元素,溶液中D元素的结构示意图为 ,
,
故答案为:Al3+; ;
;
③D的最高价氧化物的水化物是氢氧化钙,氢氧化钙的电子式为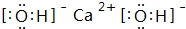 ,C的最高价氧化物的水化物是Al(OH)3,
,C的最高价氧化物的水化物是Al(OH)3,
故答案为: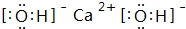 ;Al(OH)3;
;Al(OH)3;
④B是F元素,其氢化物的结构式为H-F,
故答案为:H-;
⑤熔融状态下氯化铝不导电,所以工业上采用电解熔融氧化铝的方法冶炼Al,反应方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
故答案为:氯化铝为共价化合物,熔化时不导电;2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
点评 本题考查原子结构和元素周期律的关系,为高频考点,侧重考查学生分析判断及知识综合应用能力,明确元素周期表结构及原子结构、元素化合物性质是解本题关键,知道工业上不能用电解氯化铝冶炼Al的原因,为易错点.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案| A. | 只能有一种分类标准 | B. | 分类标准不同,物质所属类别不同 | ||
| C. | 可能有多种分类标准 | D. | 一种分类标准对应一种分类结果 |
| A. | Ba2+、C1-、$SO_4^{2-}$、K+ | B. | H+、S2-、Na+、NO3- | ||
| C. | Ca2+、$HCO_3^-$、C1-、K+ | D. | Ag+、$NO_3^-$、Cl-、K+ |
| A. | 0.15mol/L | B. | 0.10mol/L | C. | 0.50mol/L | D. | 0.20mol/L |
①乙酸 ②乙醇③乙酸乙酯④氯乙烷.
| A. | ① | B. | ②③ | C. | ②④ | D. | ①③④ |