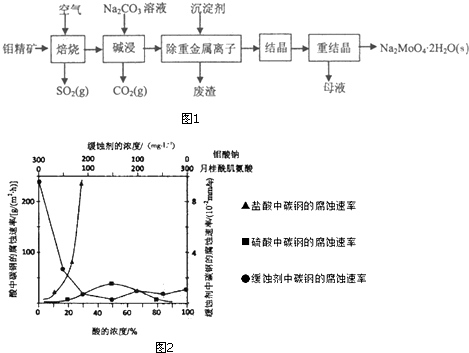
题目内容
16.在浓硝酸中放入铜片:(1)开始反应实验现象为溶液逐渐变蓝色,有红棕色气体逸出.
(2)若铜有剩余,则反应将要结束时的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
(3)待反应停止后,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是(写离子方程式)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时共产生NO2、NO的混合气体4.48L (标准状况下).则所消耗的硝酸的物质的量是0.6mol,所得气体的平均相对分子质量为38.
分析 (1)Cu和浓硝酸反应生成红棕色气体二氧化氮,同时生成硝酸铜,铜离子呈蓝色;
(2)如果铜有剩余,反应结束前,硝酸变为稀硝酸,稀硝酸和铜反应生成硝酸铜和NO;
(3)加入稀硫酸后,相当于溶液中有硝酸,Cu和硝酸发生反应生成NO;
(4)铜和硝酸反应生成硝酸铜与NO2、NO的混合气体,反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量;
依据氧化剂与得到的电子数与还原剂失去的电子数相等计算二氧化氮和一氧化氮的物质的量进而求其相对分子质量.
解答 解:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,二氧化氮是红棕色气体,铜盐溶液呈蓝色,所以看到的现象是:溶液逐渐变蓝色,有红棕色气体逸出,
故答案为:溶液逐渐变蓝色,有红棕色气体逸出;
(2)铜有剩余,随着反应的进行,硝酸浓度逐渐减小,当变为稀硝酸时,铜和稀硝酸反应生成硝酸铜和NO,反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)加入稀硫酸后,氢离子原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应,发生的离子反应方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,
根据氮原子守恒得消耗的n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.2mol=0.6mol;
设生成的二氧化氮的物质的量xmol,生成的一氧化氮的物质的量为ymol,
结合转移电子守恒列方程组为$\left\{\begin{array}{l}{x+y=0.2}\\{x+3y=0.2×2}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.1}\\{y=0.1}\end{array}\right.$,
混合气体平均分子摩尔质量=$\frac{0.1mol×(30+46)g/mol}{0.2mol}$=38g/mol,所以混合气体平均相对分子质量为38,
故答案为:0.6 mol;38.
点评 本题以硝酸和Cu的反应为载体考查氧化还原反应计算等知识点,为高频考点,侧重考查学生分析判断及计算能力,易错点是(3)题,酸性条件下,硝酸根离子具有强氧化性,题目难度不大.

| A. | 115号元素位于周期表第八周期 | |
| B. | 该115号的元素的这种核素的原子中,中子数与电子数之差为174 | |
| C. | 1个115号元素的原子与1个12C原子质量之比为115:12 | |
| D. | 115号元素可显+5价 |
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
(1)写出与Y2互为等电子体的分子式CO;
(2)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na;
(3)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,Q的配位数为4,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是sp、sp3.
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:BKNO3;CKAl(SO4)2.
(2)写出过量E滴入到C溶液中的离子反应方程式Al3++4OH-═AlO2-+2H2O.
(3)在A溶液中加澄清石灰水,其离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O.
(4)写出检验D中阴离子的方法取样,先加盐酸,再滴加氯化钡溶液.
①乙酸 ②乙醇③乙酸乙酯④氯乙烷.
| A. | ① | B. | ②③ | C. | ②④ | D. | ①③④ |