题目内容
19.若某基态原子的外围电子排布为3d34s2,则下列说法正确的是( )| A. | 该元素基态原子核外共有7种运动状态不同的电子 | |
| B. | 该元素位于周期表的S 区,属于金属元素 | |
| C. | 该元素在周期表中的位置第四周期第VA族 | |
| D. | 该元素M层含有11个电子 |
分析 某基态原子的外围电子排布为3d34s2,该元素基态原子的电子排布式为1s22s22p63s23p63d34s2,该元素原子最外层为4s2,原子有4个电子层,据此解答.
解答 解:某基态原子的外围电子排布为3d34s2,该元素基态原子的电子排布式为1s22s22p63s23p63d34s2.
A.该元素基态原子中共有23个电子,所以有23种运动状态不同的电子,故A错误;
B、该元素位于周期表的d区,属于金属元素,故B错误;
C、该元素在周期表中的位置第四周期第VB族,故C错误;
D、第三层上的电子数为:3+2+6=11,所以该元素M层含有11个电子,故D正确;
故选D.
点评 本题考查核外电子排布规律,难度中等,注意构造原理写出元素基态原子的电子排布式.

练习册系列答案
相关题目
9.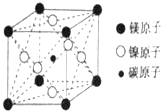 最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
 最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )| A. | MgCNi3 | B. | Mg2CNi3 | C. | MgCNi2 | D. | MgC2Ni |
10.下列各组离子在溶液中能大量共存的是( )
| A. | Ba2+、C1-、$SO_4^{2-}$、K+ | B. | H+、S2-、Na+、NO3- | ||
| C. | Ca2+、$HCO_3^-$、C1-、K+ | D. | Ag+、$NO_3^-$、Cl-、K+ |
11.已知115号元素的一种核素为289X,下列有关115号元素的有关叙述正确的是( )
| A. | 115号元素位于周期表第八周期 | |
| B. | 该115号的元素的这种核素的原子中,中子数与电子数之差为174 | |
| C. | 1个115号元素的原子与1个12C原子质量之比为115:12 | |
| D. | 115号元素可显+5价 |
8.有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:BKNO3;CKAl(SO4)2.
(2)写出过量E滴入到C溶液中的离子反应方程式Al3++4OH-═AlO2-+2H2O.
(3)在A溶液中加澄清石灰水,其离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O.
(4)写出检验D中阴离子的方法取样,先加盐酸,再滴加氯化钡溶液.
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:BKNO3;CKAl(SO4)2.
(2)写出过量E滴入到C溶液中的离子反应方程式Al3++4OH-═AlO2-+2H2O.
(3)在A溶液中加澄清石灰水,其离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O.
(4)写出检验D中阴离子的方法取样,先加盐酸,再滴加氯化钡溶液.

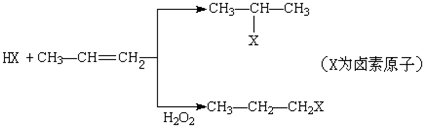
 的物质,该物质是一种香料.
的物质,该物质是一种香料.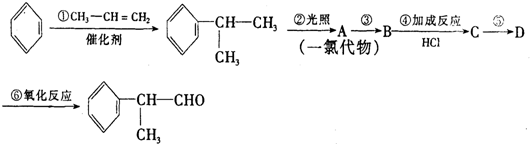
 ,
,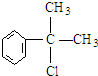 .
.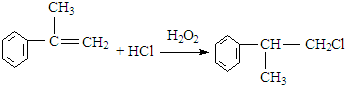 .反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):
.反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):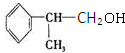 +NaCl.
+NaCl.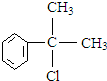 的水解产物
的水解产物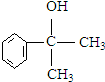 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. ,
, ,
, .
.