题目内容
13.如图为分离提纯物质的实验装置图,按要求回答下列问题: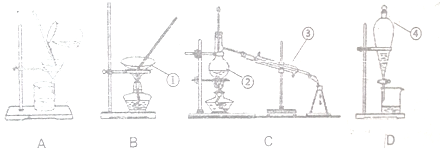
①蒸发皿;②蒸馏烧瓶;③冷凝管;④分液漏斗;
(2)分别写出玻璃棒在实验中的作用
A操作引流作用;
B操作搅拌作用.
分析 (1)由图及装置可知仪器的名称;
(2)A为过滤装置,玻璃棒起引流作用;B为蒸发操作,玻璃棒起搅拌作用.
解答 解:(1)由图可知,仪器①②③④分别为蒸发皿、蒸馏烧瓶、冷凝管、分液漏斗,故答案为:蒸发皿;蒸馏烧瓶;冷凝管;分液漏斗;
(2)A为过滤装置,玻璃棒起引流作用;B为蒸发操作,玻璃棒起搅拌作用,防止局部温度过高,造成液滴飞溅,
故答案为:引流作用;搅拌作用.
点评 本题考查混合物分离提纯,为高频考点,把握仪器的使用、混合物分离提纯实验为解答的关键,侧重分析与实验能力的考查,注意玻璃棒的作用,题目难度不大.

练习册系列答案
相关题目
8.下列离子方程式正确的是( )
| A. | 工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O | |
| B. | 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
18.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | 标准状况下,11.2 L NO与11.2 L O2混合所含原子数为2 NA | |
| D. | 将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
5.有甲、乙两醋酸稀溶液,测得甲的pH=a,乙的pH=a+1.下列推断中正确的是( )
| A. | 物质的量浓度c(甲)=10c(乙) | |
| B. | 甲中由水电离产生的H+的物质的量浓度和乙的相等 | |
| C. | 中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲) | |
| D. | 甲中的c(OH-)为乙中c(OH-)的10倍 |
2.下列有关电解质溶液的说法正确的是( )
| A. | 用CH3COOH溶液做导电实验,灯泡很暗,证明CH3COOH是弱电解质 | |
| B. | pH相同的醋酸和盐酸,取等体积的两种酸溶液分别稀释至原溶液体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m<n | |
| C. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小且c(NH4+)/c(NH3•H2O)的值增大 | |
| D. | 常温下,CH3COOH的Ka=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O的溶液中的c(OH-)相等 |
3.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 12g石墨和C60的混合固体中,含NA个碳原子 | |
| B. | 标准状况下,2.24L水中含有0.1NA个水分子 | |
| C. | 7.8g过氧化钠含有的共用电子对数为0.2NA | |
| D. | 5.6g铁在足量氯气中燃烧,电子转移数目为0.2NA |