题目内容
1.硫酸工业在国民经济中占有极其重要的地位.我国采用“接触法’’制硫酸,设备如图1所示: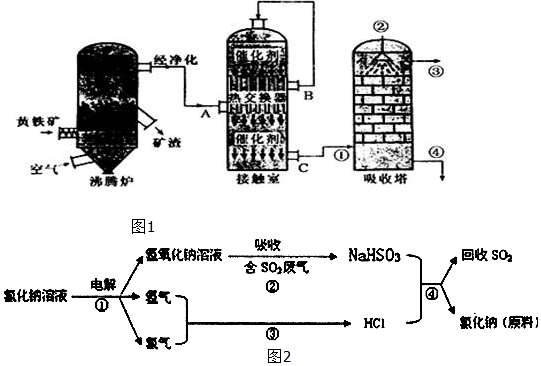
(1)用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉进行(填设备名称).
(2)为提高SO3吸收率,实际生产中用98.3%浓硫酸吸收SO3;这样做的优点是防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率.
(3)由A排出的炉渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度不同而变化(见下表):
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如图2:试写出②、④的化学反应方程式NaOH+SO2═NaHSO3、NaHSO3+HCl═NaCl+H2O+SO2↑.
分析 (1)黄铁矿的主要成分是FeS2,在沸腾炉中高温条件下与氧气反应;
(2)吸收塔中吸收液的选择从实际吸收效果考虑不采用水而采用浓硫酸,可防止产生酸雾;
(3)由表中数据分析出温度和CuSO4的质量分数之间的关系,而CuSO4的质量取决于SO3 的质量,再由反应2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g),△H=-98.3kJ•mol-1分析SO3 的质量和温度之间的关系;
(4)依据流程图分析,电解氯化钠溶液得到氢气、氯气、氢氧化钠溶液,步骤③反应条件为点燃,为氯气和氢气反应生成W为HCl,步骤②X溶液和二氧化硫反应生成亚硫酸氢钠,X为NaOH,步骤④盐酸和亚硫酸氢钠反应生成氯化钠、二氧化硫和水,最初的原料为NaCl,最终又有NaCl生成,同时回收二氧化硫.②过量的二氧化硫和氢氧化钠反应生成NaHSO3;④根据弱酸的酸式盐能与强酸反应分析.
解答 解:(1)黄铁矿的主要成分是FeS2,在沸腾炉中高温条件下与氧气反应生成二氧化硫和三氧化二铁,其反应方程式为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2; 沸腾炉;
(2)吸收塔中SO3如果用水吸收,发生反应:SO3+H2O═H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,最终得到“发烟”硫酸,
故答案为:98.3%浓硫酸;防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率;
(3)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),根据题意由表中数据可知,硫酸铜的质量分数随沸腾炉温度升高而降低,是因为反应CuO+SO3$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4中SO3的质量减少导致的,根据2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g),△H=-98.3kJ•mol-1反应制备SO3,该反应为可逆反应,正方向为放热,随着温度升高,平衡逆向移动,导致SO3的量减少,由CuO与SO3 在沸腾炉中化合而成CuSO4的量也减少,
故答案为:SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少);
(4)步骤①:电解饱和食盐水的方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,步骤②X溶液和二氧化硫反应生成亚硫酸氢钠,X为NaOH,步骤③反应条件为点燃,为氯气和氢气反应生成W为HCl,所以②为酸性气体二氧化硫与氢氧化钠反应生成亚硫酸钠和水,化学方程式为:SO2+NaOH=NaHSO3,步骤③弱酸的酸式盐NaHSO3与强酸HCl反应:NaHSO3+HCl=NaCl+SO2↑+H2O,
故答案为:SO2+NaOH=NaHSO3、NaHSO3+HCl=NaCl+SO2↑+H2O.
点评 本题考查工业接触法制硫酸的原理,同时涉及到反应原理、可逆反应的特点、反应的热效应、三氧化硫的吸收等内容,具有一定的综合性,需要一定的知识迁移能力,难度中等.

| A. | 9 | B. | ll | C. | 13 | D. | 15 |
| A. |  分离甘油和水 分离甘油和水 | B. |  用工业酒精制取无水酒精 用工业酒精制取无水酒精 | ||
| C. |  制取MgCl2固体 制取MgCl2固体 | D. |  检测蔗糖与浓硫酸反应产生的CO2 检测蔗糖与浓硫酸反应产生的CO2 |
 ,则该烯烃的结构简式可能有( )
,则该烯烃的结构简式可能有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
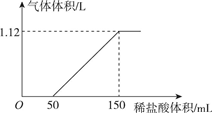 向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入0.05mol/L的稀盐酸,加入稀盐酸体积与标准状况下产生气体体积的关系如图所示.
向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入0.05mol/L的稀盐酸,加入稀盐酸体积与标准状况下产生气体体积的关系如图所示.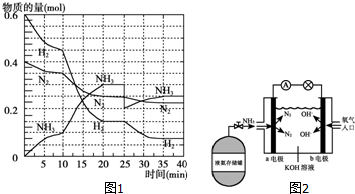 氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:
氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示: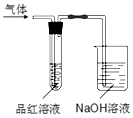 用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:
用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题: 按图所示装置进行实验,并回答下列问题:
按图所示装置进行实验,并回答下列问题: