题目内容
6.下列能达到实验目的是( )| A. |  分离甘油和水 分离甘油和水 | B. |  用工业酒精制取无水酒精 用工业酒精制取无水酒精 | ||
| C. |  制取MgCl2固体 制取MgCl2固体 | D. |  检测蔗糖与浓硫酸反应产生的CO2 检测蔗糖与浓硫酸反应产生的CO2 |
分析 A.甘油和水混溶;
B.酒精易挥发,可用蒸馏的方法制备;
C.加热时氯化镁易水解;
D.浓硫酸和蔗糖反应生成二氧化硫和二氧化碳,都使石灰水变浑浊.
解答 解:A.甘油和水混溶,不能用分液的方法分离,故A错误;
B.酒精易挥发,可用蒸馏的方法制备,温度计以及水的进出方向正确,故B正确;
C.加热时氯化镁易水解,应通入氯化氢,抑制水解,故C错误;
D.浓硫酸和蔗糖反应生成二氧化硫和二氧化碳,都使石灰水变浑浊,应先除去二氧化硫,故D错误.
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质的分离、检验等知识点,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,易错选项是D.

练习册系列答案
相关题目
14.已知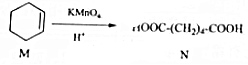 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )
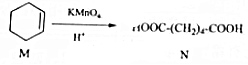 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )| A. | M中所有碳原子均位于同一平面,且与苯互为同系物 | |
| B. | 与N含有相同官能团的同分异构体共有8种 | |
| C. | M能发生加成反应和取代反应 | |
| D. | N与乙醇发生酯化反应,生成物的分子式一定为C8H14O4 |
1.下列措施中,能使饱和食盐水中c(OH-)减小的是( )
| A. | 加热 | B. | 投入金属钠 | C. | 加入NaHSO4固体 | D. | 以惰性电极电解 |
1.硫酸工业在国民经济中占有极其重要的地位.我国采用“接触法’’制硫酸,设备如图1所示: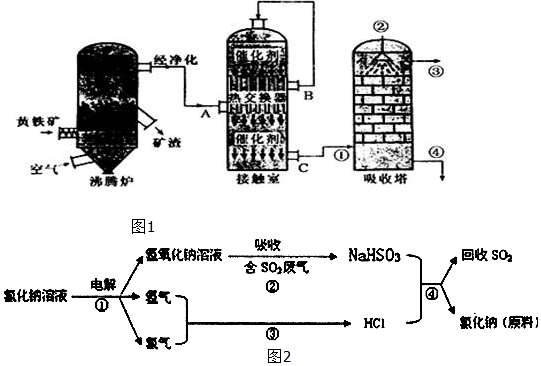
(1)用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉进行(填设备名称).
(2)为提高SO3吸收率,实际生产中用98.3%浓硫酸吸收SO3;这样做的优点是防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率.
(3)由A排出的炉渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度不同而变化(见下表):
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡逆移,SO3物质的量减少,故CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如图2:试写出②、④的化学反应方程式NaOH+SO2═NaHSO3、NaHSO3+HCl═NaCl+H2O+SO2↑.

(1)用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉进行(填设备名称).
(2)为提高SO3吸收率,实际生产中用98.3%浓硫酸吸收SO3;这样做的优点是防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率.
(3)由A排出的炉渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度不同而变化(见下表):
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如图2:试写出②、④的化学反应方程式NaOH+SO2═NaHSO3、NaHSO3+HCl═NaCl+H2O+SO2↑.
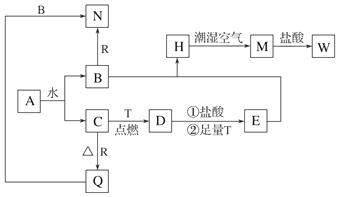
 ,X的电子式是
,X的电子式是 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. .
.