题目内容
11.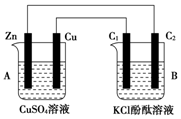 按图所示装置进行实验,并回答下列问题:
按图所示装置进行实验,并回答下列问题:(1)判断装置的名称:A池为原电池,B池为电解池.
(2)锌极为负极,电极反应式为Zn-2e-═Zn2+;铜极上的电极反应式为Cu2++2e-=Cu;石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑;石墨棒C2附近发生的实验现象为有无色气泡产生附近溶液变红色.
(3)当C2极析出224mL气体(标准状况下)时,CuSO4溶液的质量变化为:增加了0.01g.
分析 (1)左边装置能自发的进行氧化还原反应,所以为原电池,右边装置为电解池;
(2)原电池中锌作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极电极反应式为Cu2++2e-=Cu,石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e-=H2↑,根据溶液中氢离子浓度变化判断pH变化;
(3)根据串联电路中转移电子相等进行计算.
解答 解:(1)左边装置能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,右边装置有外接电源,属于电解池,故答案为:原电池;电解池;
(2)锌为负极,电极反应式Zn-2e-═Zn2+,铜为正极,铜极上的电极反应式为Cu2++2 e-=Cu,石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e-=H2↑,石墨棒C2附近还生成氢氧根离子,导致溶液碱性增强,则溶液的pH增大,酚酞遇碱变红色,所以石墨棒C2附近发生的实验现象是:有气体生成、溶液变红色,
故答案为:负;Zn-2e-═Zn2+;Cu2++2 e-=Cu;阳;2Cl--2e-=Cl2↑;有无色气泡产生附近溶液变红色;
(3)C2极析出的气体是氢气,氢气的物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,原电池中锌作负极而被腐蚀,所以随着反应的进行,锌的质量逐渐减少,生成0.01mol氢气转移电子的物质的量=0.01mol×2=0.02mol,根据串联电路中转移电子相等知,锌减少的质量=$\frac{0.02mol}{2}$×65g/mol=0.65g,在原电池中,锌作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极电极反应式为Cu2++2e-=Cu,转移0.02mol电子,溶解0.65gZn,析出0.64gCu,溶液质量增加0.01g,
故答案为:增加了0.01g.
点评 本题考查了原电池和电解池原理,根据反应的自发性确定原电池和电解池,再结合各个电极上发生的反应来分析解答,难点是电极反应式的书写,题目难度不大.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案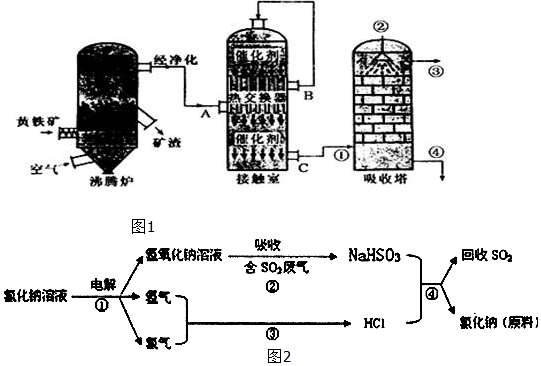
(1)用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉进行(填设备名称).
(2)为提高SO3吸收率,实际生产中用98.3%浓硫酸吸收SO3;这样做的优点是防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率.
(3)由A排出的炉渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度不同而变化(见下表):
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如图2:试写出②、④的化学反应方程式NaOH+SO2═NaHSO3、NaHSO3+HCl═NaCl+H2O+SO2↑.
| A. | 某温度下,纯水pH=6,该温度下1L pH=10的氨水中含有OH-数目为0.01NA | |
| B. | 0.1mol•L-1的AlCl3溶液与NaOH溶液反应所得产物中含Al为0.1NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24L,则参加反应的硫酸为0.4NA | |
| D. | 42gC3H6和C4H8的混合气体中含有共价键的数目为3NA |
(1)N元素位于周期表第2周期VA族.
(2)用“>”、“<”或“=”填空:
| 离子半径 | 得电子能力 | 酸性 | 金属性 |
| Cl->Al3+ | 16O=18O | H2CO3>H2SiO3 | Cu<Al |
(4)写出MgCl2电子式:
 .
.(5)在${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、${\;}_{12}^{23}$Mg、${\;}_{12}^{24}$Mg和${\;}_{29}^{65}$Cu中共有3种元素,6种核素.
| 原子组成 | Z | N | A |
| 3919K | 19 | 20 | 39 |
| 168O | 8 | 8 | 16 |
| 4018Ar | 18 | 22 | 40 |
| A. | 干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同 | |
| B. | 化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键 | |
| C. | CH4和CCl4中,每个原子的最外层都具有8电子稳定结构 | |
| D. | NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响 |
| A. | 1mol Na2CO3和1mol NaOH | B. | 1mol Na2CO3和2mol NaOH | ||
| C. | 2mol Na2CO3和2mol NaOH | D. | 2mol Na2CO3 |
 ,X的电子式是
,X的电子式是 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. .
.