题目内容
2.25℃时,将某强酸和强碱溶液按10:1 的体积比混合后溶液恰好呈中性,则混合前强酸和强碱溶液的pH之和为( )| A. | 9 | B. | ll | C. | 13 | D. | 15 |
分析 25℃时,pH=7为中性,先设出强酸、强碱的pH值,利用酸碱混合后溶液显中性,则n(H+)=n(OH-),然后可依据物质的量的关系来列式寻找pH的关系.
解答 解:设强酸的pH=a,强碱的pH=b,
由25℃时,若10体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,
即n(H+)=n(OH-),
则10×10-a=1×10b-14,
101-a=10b-14,
即1-a=b-14,
则a+b=15,
故pH(酸)+pH(碱)=15,
故选D.
点评 本题考查酸碱混合的计算,为高频考点,把握溶液为中性、pH的计算为解答的关键,侧重分析与计算能力的考查,注意浓度与pH的换算,题目难度不大.

练习册系列答案
相关题目
12.下列有关化学用语表示正确的是( )
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | B. | 16O与18O互为同位素 | ||
| C. | 氯离子的结构示意图: | D. | NaClO的电子式: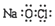 |
10.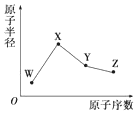 W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
 W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )| A. | X的非金属性是同周期中最强的 | |
| B. | 对应气态氢化物的稳定性:Y>Z | |
| C. | 对应简单离子半径:X>W | |
| D. | Y的氧化物能与X的最高价氧化物对应的水化物反应 |
7.用石墨电极完成下列电解实验.下列对实验现象的解释或推测不合理的是( )
| 实验装置 | 实验现象 |
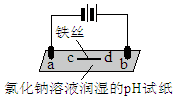 | a处试纸变蓝; b处变红,局部褪色; c处试纸变蓝; d处无明显变化 |
| A. | a为电解池的阴极 | |
| B. | b处有氯气生成,且与水反应生成了盐酸和次氯酸 | |
| C. | d处发生了反应:Fe-3e-=Fe3+ | |
| D. | c处:2H2O+2e-=H2↑+2OH- |
14.已知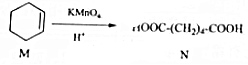 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )
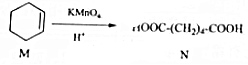 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )| A. | M中所有碳原子均位于同一平面,且与苯互为同系物 | |
| B. | 与N含有相同官能团的同分异构体共有8种 | |
| C. | M能发生加成反应和取代反应 | |
| D. | N与乙醇发生酯化反应,生成物的分子式一定为C8H14O4 |
1.硫酸工业在国民经济中占有极其重要的地位.我国采用“接触法’’制硫酸,设备如图1所示: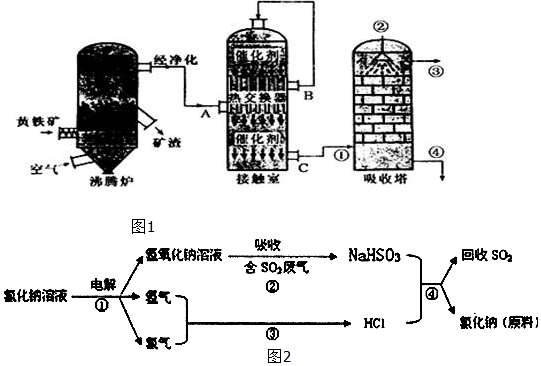
(1)用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉进行(填设备名称).
(2)为提高SO3吸收率,实际生产中用98.3%浓硫酸吸收SO3;这样做的优点是防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率.
(3)由A排出的炉渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度不同而变化(见下表):
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡逆移,SO3物质的量减少,故CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如图2:试写出②、④的化学反应方程式NaOH+SO2═NaHSO3、NaHSO3+HCl═NaCl+H2O+SO2↑.

(1)用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉进行(填设备名称).
(2)为提高SO3吸收率,实际生产中用98.3%浓硫酸吸收SO3;这样做的优点是防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率.
(3)由A排出的炉渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度不同而变化(见下表):
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如图2:试写出②、④的化学反应方程式NaOH+SO2═NaHSO3、NaHSO3+HCl═NaCl+H2O+SO2↑.
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 某温度下,纯水pH=6,该温度下1L pH=10的氨水中含有OH-数目为0.01NA | |
| B. | 0.1mol•L-1的AlCl3溶液与NaOH溶液反应所得产物中含Al为0.1NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24L,则参加反应的硫酸为0.4NA | |
| D. | 42gC3H6和C4H8的混合气体中含有共价键的数目为3NA |