题目内容
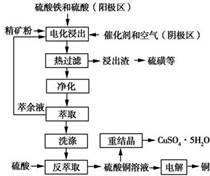
17.某小组同学在实验室研究Al与CuCl2溶液的反应.| 实验操作 | 实验现象 |
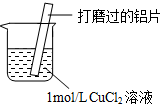 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
分析 (1)在金属活动顺序表中,排在前面的金属能从盐溶液中置换出后面的金属,铝和硫酸铜溶液发生置换反应生成铜;
(2)①氯化铜是强酸弱碱盐水解溶液显酸性;
②氯置换出铜附着在铝表面在电解质溶液中形成原电池反应,铜做负极,溶液中氢离子在铜电极发生还原反应生成氢气;
(3)①依据实验步骤可知步骤d是验证Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色,所以步骤c是验证白色沉淀可能是CuCl,检验反应后的溶液中是否含氯离子;
②氯化亚铜白色沉淀在水溶液中存在沉淀溶解平衡,加入浓氨水会和亚铜离子形成Cu(NH3)2+(无色),平衡正向进行促进沉淀溶解;
(4)①若是Cu与CuCl2溶液反应生成了CuCl,元素化合价分析可知铜化合价0价变化为+1价,元素化合价升高失电子做还原剂发生氧化反应;
②铝和氯化铜溶液反应过程中有白色沉淀生成,反应过程非常大量热量,证明了Cu与CuCl2溶液反应生成CuCl,可以加热观察是否生成白色沉淀.
解答 解:(1)铝的活泼些大于铜,和硫酸铜溶液发生置换反应生成铜,铝表面析出红色的铜,
故答案为:Cu;
(2)①氯化铜是强酸弱碱盐水解溶液显酸性,CuCl2+2H2O?Cu(OH)2+2HCl,溶液中存在大量H+的原因是因为水解生成的,反应的离子方程式为:Cu2++2H2O?Cu(OH)2+2H+,
故答案为:Cu2++2H2O?Cu(OH)2+2H+;
②氯置换出铜附着在铝表面在电解质溶液中形成原电池反应,铜做负极,溶液中氢离子在铜电极发生还原反应生成氢气,电极反应为2H++2e-=H2↑,
故答案为:Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气;
(3)①依据实验步骤可知步骤d是验证Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色,所以步骤c是验证白色沉淀可能是CuCl,检验反应后的溶液中是否含氯离子,步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液,观察是否生成白色沉淀判断氯离子的存在,
故答案为:加入足量的稀硝酸,再滴加几滴硝酸银溶液;
②氯化亚铜白色沉淀在水溶液中存在沉淀溶解平衡,加入浓氨水会和亚铜离子形成Cu(NH3)2+(无色),平衡正向进行促进沉淀溶解,用化学平衡移动原理解释CuCl溶于浓氨水的原因是:CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解,
故答案为:CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解;
(4)①若是Cu与CuCl2溶液反应生成了CuCl,元素化合价分析可知铜化合价0价变化为+1价,元素化合价升高失电子做还原剂发生氧化反应,铜表现的是还原性,
故答案为:还原;
②铝和氯化铜溶液反应过程中有白色沉淀生成,反应过程非常大量热量,证明了Cu与CuCl2溶液反应生成CuCl,可以加热观察是否生成白色沉淀,若加热出现沉淀说明Cu与CuCl2溶液反应生成了CuCl,若不出现沉淀说明Cu与CuCl2溶液不能反应生成了CuCl,
故答案为:加热.
点评 本题考查了Al与CuCl2溶液的反应、反应现象、物质检验的实验设计等知识,掌握铝、铜及其化合物的性质以及沉淀溶解平衡有关知识是解题关键,题目难度中等,试题培养了学生的分析能力及化学实验能力.

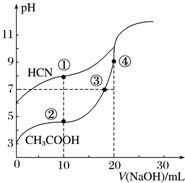 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①和点②所示溶液中:c(CH3COO-)<c(CN-) | |
| B. | 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
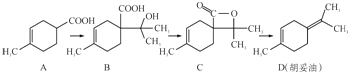
下列说法不正确的是( )
| A. | 若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应 | |
| B. | 有机物B既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 | |
| C. | 有机物C的所有同分异构体中不可能有芳香族化合物存在 | |
| D. | 有机物D能发生加成、取代、氧化、还原等反应 |
 常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )
常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )| A. | ②点混合溶液中水电离出的c(H+)大于酸HA溶液中由水电离出的c(H+) | |
| B. | ③点混合溶液中各离子浓度的大小关系是c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | 酸HA溶液的浓度为0.1 mol•L-1 | |
| D. | ④点溶液中,存在c(HA)+c(H+)>c(M+)+c(OH-) |
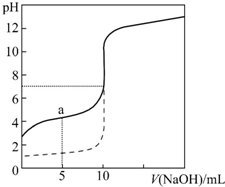 常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )
常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )| A. | 图中虚线表示NaOH溶液滴定盐酸时的pH变化 | |
| B. | 酸溶液的体积均为10 mL | |
| C. | a点:c(CH3COO-)>c(CH3COOH) | |
| D. | 当pH=7时,滴定醋酸消耗的V(NaOH)=10 mL,且c(CH3COO-)=c(Na+) |

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙干燥氨气 | |
| C. | 用装置丙除去甲烷中混有的乙烯 | |
| D. | 利用装置丁制取硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |