题目内容
2. 常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )
常温下,向20.00mL 0.1mol•L-1的MOH溶液中逐滴加入一定浓度的HA溶液.滴加过程中,溶液的pH与滴入HA溶液的体积关系如图所示,当pH=8时MOH溶液恰好被中和.则下列说法中错误的是( )| A. | ②点混合溶液中水电离出的c(H+)大于酸HA溶液中由水电离出的c(H+) | |
| B. | ③点混合溶液中各离子浓度的大小关系是c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | 酸HA溶液的浓度为0.1 mol•L-1 | |
| D. | ④点溶液中,存在c(HA)+c(H+)>c(M+)+c(OH-) |
分析 A、②点混合溶液二者恰好反应,生成强碱弱酸盐,水解促进水的电离;
B、③点溶液呈中性,根据电荷守恒:c(M+)+c(H+)=c(A-)+c(OH-)来比较判断;
C、由图象知②点混合溶液二者恰好反应,消耗酸HA溶液的体积为20.00 mL,据此计算酸HA溶液的浓度;
D、④点溶液为等物质的量的HA和MA的混合溶液,存在电荷守恒和物料守恒.
解答 解:A、②点混合溶液二者恰好反应,生成强碱弱酸盐,水解促进水的电离,混合溶液中水电离出的c(H+)大于HA溶液中由水电离出的c(H+),故A正确;
B、③点溶液呈中性,溶液中离子浓度关系为c(M+)=c(A-)>c(H+)=c(OH-),故B正确;
C、②点混合溶液二者恰好反应,消耗酸HA溶液的体积为20.00 mL,酸HA溶液的浓度为0.1 mol•L-1,故C正确;
D、④点溶液为等物质的量的HA和MA的混合溶液,由电荷守恒c(M+)+c(H+)=c(A-)+c(OH-)和物料守恒c(A-)+c(HA)=2c(M+),将两式相加求得c(HA)+c(H+)=c(M+)+c(OH-),故D错误.
故选D.
点评 本题考查了酸碱反应的图象分析,溶液中电荷守恒,离子浓度大小比较,题目难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.以下说法正确的是( )
| A. | 苯与液溴在FeBr3的催化作用下,发生取代反应 | |
| B. | 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 葡萄糖、蔗糖、淀粉在催化剂作用下,均可以发生水解反应 |
13.常温下,下列各组离子在指定溶液中一定可以大量共存的是( )
| A. | 1.0mol/L的硝酸钾溶液中:Mg2+,Fe2+、Cl-、SO42- | |
| B. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:Ca2+,K+、Br-、HCO3- | |
| C. | 在pH=1的溶液中:NH4+、Na+、ClO-、Cl- | |
| D. | 无色溶液中:Al3+、Na+、S2-、Cl- |
10.下列叙述中正确的是( )
| A. | K3C60在熔融状态下能够导电,所以K3C60是电解质 | |
| B. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| C. | 胶体和溶液的本质区别在于能否发生丁达尔现象 | |
| D. | 变化过程中化学键被破坏,则一定发生化学变化 |
17.某小组同学在实验室研究Al与CuCl2溶液的反应.
(1)现象ⅰ中的红色物质是Cu.
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
| 实验操作 | 实验现象 |
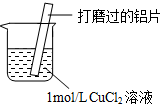 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
7.X、Y、Z、W均为短周期主族元素,原子序数依次增加,且最外层电子数分别为5、6、6、7,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
| A. | 阴离子的还原性:Z>Y | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
14.NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 标准状况下,0.5NA个Br2分子所占的体积为11.2 L | |
| B. | 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后得到的NH3分子数小于NA | |
| C. | 标准状况下,6.72 L Cl2与足量的NaOH溶液反应,转移的电子数为0.3NA | |
| D. | 在0.1 mol•L-1NH4Cl溶液中阳离子的数目可能为NA |
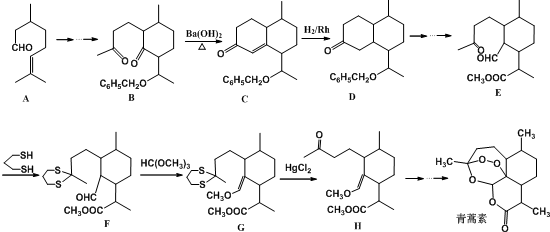
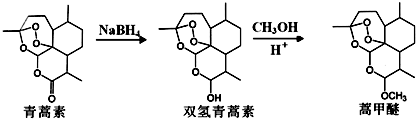
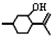 ,则异蒲勒醇分子有3个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子).异蒲勒醇可通过两步反应生成
,则异蒲勒醇分子有3个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子).异蒲勒醇可通过两步反应生成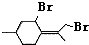 ,请写出相关化学反应方程式
,请写出相关化学反应方程式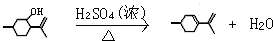 ,
,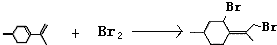 .
.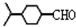 .(填结构简式)
.(填结构简式)