题目内容
8.膜反应器是膜过程和反应过程相结合的新型技术设备,同时具备了反应和分离的功能.对于可逆反应,通过膜扩散过程移走产物,提高转化率.利用膜反应器改进硫酸制备工艺,如以下流程图所示.硫铁矿(FeS2)燃烧产生的SO2,通过下列碘循环工艺过程既能制H2SO4,又能制H2.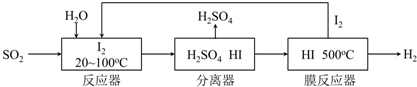
请回答下列问题:
(1)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3408kJ•mol-1
(2)该循环工艺过程的总反应方程式为SO2+2H2O=H2SO4+H2
(3)HI分解反应为2HI?H2+I2,该反应的平衡常数表达式为K=$\frac{c(H2)c(I2)}{c2(HI)}$.用化学平衡移动的原理分析,在HI分解反应中,使用膜反应器分离出H2的目的是有利于平衡向右移动,有利于碘和氢气的生成
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池.电池充放电时的总反应为:
NiO(OH)+MH$?_{充电}^{放电}$Ni(OH)2+M
①MH中M的化合价是0
②电池放电时,负极的电极反应式为MH-e-+OH-=H2O+M
③充电完成时,Ni(OH)2全部转化为NiO(OH).若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为O2+4e-+2H2O=4OH-或4MH+O2+4e-=2H2O+4M.
分析 (1)根据题目所给物质的量的多少结合热化学方程式的书写方法来回答,反应的化学方程式为:4FeS2+11O2=2Fe2O3+8SO2,标出各物质的聚集状态;在反应中4 mol FeS2的质量为m(FeS2)=4 mol×120 g•mol-1=480 g,放热Q=480 g×7.1 kJ/g=3408 kJ,标注物质聚集状态和对应反应的焓变写出;
(2)根据该循环的工艺流程是用硫铁矿(FeS2)燃烧产生的SO2来制硫酸,在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI?I2+H2,将两个方程式相加得;
(3)根据平衡移动的原理来分析,将H2分离出来有利于平衡向右移动,利于I2和H2的生成;
(4)①用吸收H2后的稀土储氢合金作为电池负极材料,放电做负极失电子发生氧化反应;
②根据负极反应的特点和总电池反应来回答,负极反应物MH失去电子,生成的H+在碱性条件下生成H2O;
③根据氧气进入另一个电极阴极上是氧气发生的电子的过程.
解答 解:(1)反应的化学方程式为:4FeS2+11O2=2Fe2O3+8SO2,标出各物质的聚集状态;在反应中4 mol FeS2的质量为m(FeS2)=4 mol×120 g•mol-1=480 g,放热Q=480 g×7.1 kJ/g=3408 kJ,对应的热化学方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ•mol-1,故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ•mol-1;
(2)在反应器中发生反应:SO2+I2+2H2O=2HI+H2SO4,在膜反应器中的反应为:2HI?I2+H2,将两个方程式相加得:SO2+2H2O=H2SO4+H2,故答案为:SO2+2H2O=H2SO4+H2;
(3)在膜分离器中发生反应:2HI?I2+H2,将H2分离出来有利于平衡向右移动,利于I2和H2的生成,故答案为:有利于平衡向右移动,有利于碘和氢气的生成;
(4)①用吸收H2后的稀土储氢合金作为电池负极材料,放电做负极失电子发生氧化反应,MH中M化合价为0价,
故答案为:0;
②负极反应物MH失去电子,生成的H+在碱性条件下生成H2O,电解反应式为:MH-e-+OH-=H2O+M,故答案为:MH-e-+OH-=H2O+M;
③阴极上是氧气发生的电子的过程,电极反应式为:O2+4e-+2H2O=4OH- 或4MH+O2+4e-=2H2O+4M,
故答案为:O2+4e-+2H2O=4OH- 或4MH+O2+4e-=2H2O+4M.
点评 本题考查了热化学方程式书写、氧化还原反应化学方程式、化学平衡的影响因素、电解池原理的理解应用,掌握基础是解题关键,题目难度中等.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案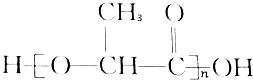 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的单体是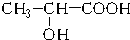 | ||
| C. | 聚乳酸是一种羧酸 | D. | 其聚合方式和乙烯相同 |
| A. | 大力防治 PM2.5 的污染防治,可减少雾霾天气 | |
| B. | “84 消毒液”具有强氧化性,可作环境的消毒剂 | |
| C. | 发展低碳经济,利用太阳能、风能实现城市照明 | |
| D. | 可以用福尔马林溶液保存海鲜产品 |
 室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )
室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )| A. | 当Ⅰ代表HB,b点时体系中有:c(B-)+c(HB)=0.05mol/L | |
| B. | 滴定分析中,甲基橙不能用做滴定曲线Ⅰ中的指示剂 | |
| C. | a点时的溶液中离子浓度最大的是c(Na+) | |
| D. | 若Ⅱ代表HA的滴定曲线,则Ka(HB)≈10-5 |
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 屠呦呦获得了2015年诺贝尔奖,她用乙醚提取青蒿素的过程属于化学变化 |
| A. | 1.0mol/L的硝酸钾溶液中:Mg2+,Fe2+、Cl-、SO42- | |
| B. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:Ca2+,K+、Br-、HCO3- | |
| C. | 在pH=1的溶液中:NH4+、Na+、ClO-、Cl- | |
| D. | 无色溶液中:Al3+、Na+、S2-、Cl- |

| A. | 用图1装置蒸发FeCl3溶液制备无水FeCl3 | |
| B. | 用图2装置精炼铝 | |
| C. | 用图3装置证明浓硫酸具有脱水性和强氧化性 | |
| D. | 用图4装置可比较氯、碳、硅三种元素的非金属性强弱 |
| 实验操作 | 实验现象 |
 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |