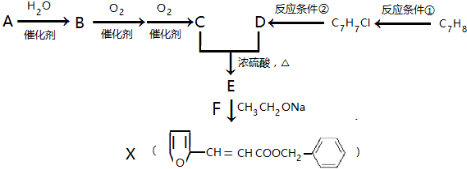
题目内容
6.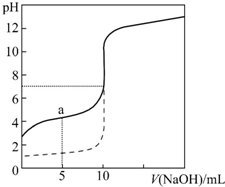 常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )
常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )| A. | 图中虚线表示NaOH溶液滴定盐酸时的pH变化 | |
| B. | 酸溶液的体积均为10 mL | |
| C. | a点:c(CH3COO-)>c(CH3COOH) | |
| D. | 当pH=7时,滴定醋酸消耗的V(NaOH)=10 mL,且c(CH3COO-)=c(Na+) |
分析 A、根据图示滴定前实线对应酸溶液的pH大于虚线对应酸溶液的pH来判断;
B、向0.1 mol•L-1盐酸中加入10mL 0.1mol•L-1NaOH时,pH=7,恰好完全反应,据此回答;
C、a点是等物质的量CH3COOH和CH3COONa的混合溶液,据此回答;
D、当pH=7时,滴定醋酸消耗的V(NaOH)应稍小于10 mL,根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)来判断.
解答 解:A、滴定前实线对应酸溶液的pH大于虚线对应酸溶液的pH,所以实线对应酸为醋酸,虚线对应酸为盐酸,盐酸pH=1说明其浓度为0.1mol•L-1,故A正确;
B、向0.1 mol•L-1盐酸中加入10mL 0.1mol•L-1NaOH时,pH=7,所以盐酸体积为10mL,故B正确;
C、a点是等物质的量CH3COOH和CH3COONa的混合溶液,c(CH3COOH)<c(CH3COO-),故C正确;
D、当pH=7时,滴定醋酸消耗的V(NaOH)应稍小于10 mL,根据电荷守恒,此时c(CH3COO-)+c(OH-)=c(Na+)+c(H+),因为c(OH-)=c(H+),所以c(CH3COO-)=c(Na+),故D错误.
故选D.
点评 本题考查了酸碱混合后的定性判断及溶液的酸碱性与溶液pH的关系,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解判断溶液中离子浓度大小.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
16.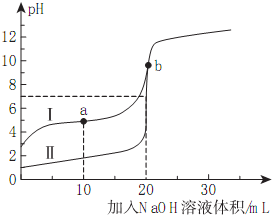 室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )
室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )
 室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )
室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如图所示.下列说法错误的是( )| A. | 当Ⅰ代表HB,b点时体系中有:c(B-)+c(HB)=0.05mol/L | |
| B. | 滴定分析中,甲基橙不能用做滴定曲线Ⅰ中的指示剂 | |
| C. | a点时的溶液中离子浓度最大的是c(Na+) | |
| D. | 若Ⅱ代表HA的滴定曲线,则Ka(HB)≈10-5 |
17.某小组同学在实验室研究Al与CuCl2溶液的反应.
(1)现象ⅰ中的红色物质是Cu.
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
| 实验操作 | 实验现象 |
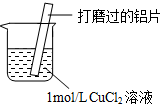 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
14.NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 标准状况下,0.5NA个Br2分子所占的体积为11.2 L | |
| B. | 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后得到的NH3分子数小于NA | |
| C. | 标准状况下,6.72 L Cl2与足量的NaOH溶液反应,转移的电子数为0.3NA | |
| D. | 在0.1 mol•L-1NH4Cl溶液中阳离子的数目可能为NA |
1.下列表示对应化学反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硝酸亚铁溶液中滴加少量稀硫酸:Fe2++NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | 把反应Cu+2FeCl3═2FeCl2+CuCl2设计成原电池,其正极反应为Fe3++e-═Fe2+ | |
| D. | 向硫酸氢钠溶液中加入氢氧化钡溶液至中性,则离子方程式为H++SO42-+Ba2++OH-═BaSO4↓+H2O |
18.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
16.选择下列实验装置,能完成对应实验的是( )
| A | B | C | D | |
| 装置 |  |  |  | 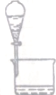 |
| 实验 | 从KI和I2的固体混合物中回收I2 | 分离混合体系中的Fe(OH)3沉淀和胶体 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离苯酚和水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
 ,其最多有11个原子共平面.
,其最多有11个原子共平面.