题目内容
7.用下列实验装置进行的实验中,能达到相应实验目的是( )
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙干燥氨气 | |
| C. | 用装置丙除去甲烷中混有的乙烯 | |
| D. | 利用装置丁制取硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
分析 A.浓盐酸和二氧化锰在加热条件下制取氯气;
B.氯化钙和氨气反应生成络合物;
C.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳;
D.阴离子交换膜只能阴离子通过,阳离子交换膜只能阳离子通过.
解答 解:A.浓盐酸和二氧化锰在加热条件下制取氯气,没有酒精灯加热,所以不能制取氯气,故A错误;
B.氯化钙和氨气反应生成络合物,则不能用氯化钙干燥氨气,应该用碱石灰干燥,故B错误;
C.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳,产生新的杂质,应该用溴水除去乙烯,故C错误;
D.阴离子交换膜只能阴离子通过,阳离子交换膜只能阳离子通过,阴极上氢离子放电生成氢气,同时阴极附近有大量的OH-离子,钠离子通过交换膜加入阴极,则b为阳离子交换膜;阳极上氢氧根离子放电生成氧气,同时阳极附近有氢离子生成,硫酸根离子通过阴离子交换膜c加入阳极,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及气体制备、气体干燥、除杂、电解等知识点,明确实验原理及物质性质是解本题关键,侧重考查学生分析判断能力,知道交换膜类型的方法,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
17.某小组同学在实验室研究Al与CuCl2溶液的反应.
(1)现象ⅰ中的红色物质是Cu.
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
| 实验操作 | 实验现象 |
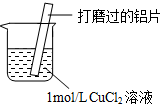 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
18.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
19.化学在生产、科研和日常生活中有着密切( )
| A. | 将水库的钢闸门与电源负极相连或将锌块焊接于闸门上以防止其生锈 | |
| B. | 用于文物年代鉴定的放射性14C和作为原子量标准的12C,化学性质不同 | |
| C. | 苯酚、甲醛分别可用于环境消毒和鱼肉等食品的防腐保鲜 | |
| D. | NO2和SO2都是酸性氧化物,都是大气污染物 |
16.选择下列实验装置,能完成对应实验的是( )
| A | B | C | D | |
| 装置 | 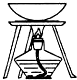 |  |  | 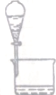 |
| 实验 | 从KI和I2的固体混合物中回收I2 | 分离混合体系中的Fe(OH)3沉淀和胶体 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离苯酚和水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
10.下列关于化学实验操作及实验现象的叙述正确的是( )
| A. | 在蒸发结晶操作中,用酒精灯加热直至溶液完全蒸干才停止加热 | |
| B. | 配制一定物质的量浓度溶液时,容量瓶必须事先干燥 | |
| C. | 用量筒取用5.0ml液体时,俯视刻度线,会使所取液体体积大于5.0ml | |
| D. | 铁氰化钾可用于Fe2+的检验 |
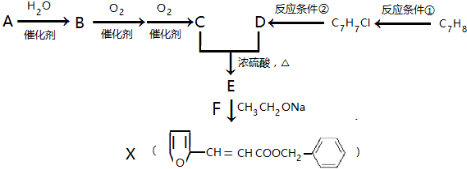
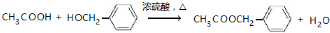
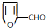 ,其最多有11个原子共平面.
,其最多有11个原子共平面.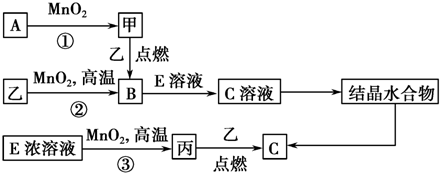
 .若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
.若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.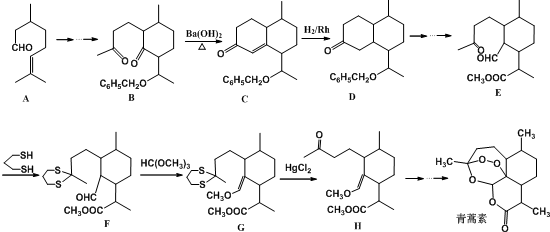
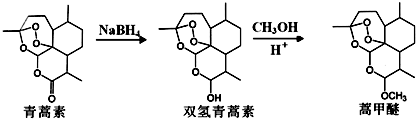
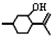 ,则异蒲勒醇分子有3个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子).异蒲勒醇可通过两步反应生成
,则异蒲勒醇分子有3个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子).异蒲勒醇可通过两步反应生成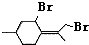 ,请写出相关化学反应方程式
,请写出相关化学反应方程式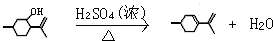 ,
,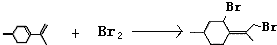 .
.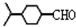 .(填结构简式)
.(填结构简式)