题目内容
3.下列物质属于电解质的是( )| A. | 石墨 | B. | 液态HCl | C. | 葡萄糖 | D. | Na2CO3溶液 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,单质和混合物既不是电解质也不是非电解质,据此进行解答.
解答 解:A.石墨是单质,所以石墨既不是电解质也不是非电解质,故A错误;
B.液态HCl在水溶液里能电离出自由移动的阴阳离子导致溶液导电,所以液态HCl是电解质,故B正确;
C.葡萄糖在水溶液里或熔融状态下都不导电,属于非电解质,故C错误;
D.碳酸钠溶液为混合物,碳酸钠溶液既不是电解质也不是非电解质,故D错误;
故选B.
点评 本题考查了电解质的判断,题目难度不大,明确电解质与非电解质的概念为解答关键,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.

练习册系列答案
相关题目
11.一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g),达到平衡后测得A气体的浓度为0.5mol•L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A浓度为0.4mol•L-1,则下列叙述正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | C的体积分数降低 | D. | B的转化率提高 |
8.将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是( )
| A. | 平均相对分子质量 | B. | SO3(g)的转化率 | ||
| C. | $\frac{c(S{O}_{3})}{c(S{O}_{2})}$ | D. | c2(SO3) |
15.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同.250C时,0.1mol/L X和W形成的化合物的水溶液pH=1.下列说法中正确的是( )
| A. | Y、Z、W三种元素组成的化合物的水溶性一定显碱性 | |
| B. | 原子半径:X<Y<Z<R<W | |
| C. | R元素的最高价氧化物的水化物酸性最强 | |
| D. | Y和其他四种元素均可形成至少两种化合物(两种元素组成) |
12.在室温下进行中和滴定,酸和碱恰好完全反应时,以下说法一定正确的是( )
| A. | 参加反应的酸和碱的物质的量相等 | |
| B. | 参加反应的酸中的H+总量和碱中的OH-总量相等 | |
| C. | 反应后混合液的pH=7 | |
| D. | 不能用适当的酸碱指示剂来判断 |
13.用电解尿素[CO(NH2)2]的碱性溶液制氢气的装置如图所示.下列说法错误的是( )
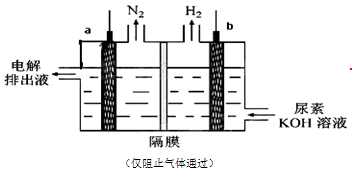

| A. | 为增强导电性,可用金属铜作阳极 | |
| B. | 电解过程中阴、阳极产生的气体物质的量之比为3:1 | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 阳极的电极反应式为:CO(NH2)2-6e-+8 OH-═CO32-+N2↑+6H2O |
 .
.
 .
.