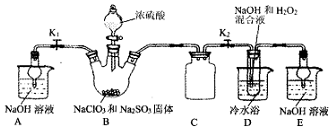
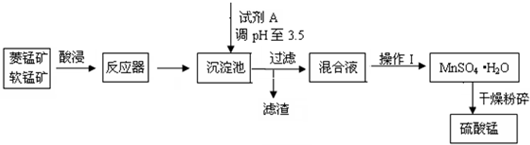
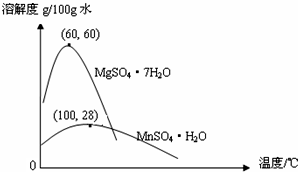
题目内容
8.二甲醚(CH3OCH3)-空气燃料电池的工作原理如图所示.电池工作时,下列说法正确的是( )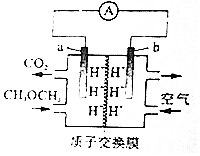
| A. | a极区域溶液的pH变大 | |
| B. | b极有H2O生成 | |
| C. | a极反应式:CH3OCH3+3O2--12e-═2CO2↑+6H+ | |
| D. | 每消耗11.2LO2(标准状况).有2molH+向左侧移动 |
分析 该燃料电池中,通入二甲醚的电极为负极,电解质溶液中存在自由移动的氢离子,所以电解质溶液呈酸性,负极电极反应式为CH3OCH3+3H2O-12e-═2CO2+12H+,正极上电极反应式为O2+4e-+4H+=2H2O,电子从负极沿导线流向正极,原电池工作时阳离子向正极移动,以此解答该题.
解答 解:A.a为负极,发生CH3OCH3+3H2O-12e-═2CO2+12H+,则pH减小,故A错误;
B.b为正极,发生O2+4e-+4H+=2H2O,有水生成,故B正确;
C.电解质中不存在O2-,为水溶液,发生CH3OCH3+3H2O-12e-═2CO2+12H+,故C错误;
D.原电池工作时,阳离子向正极移动,即向右侧移动,故D错误.
故选B.
点评 本题考查了原电池原理,为高频考点,侧重考查学生的分析能力,注意把握正负极的判断,会正确书写电极反应式,易错选项是D,注意把握离子的定向移动,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.苹果酸的结构简式为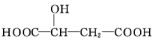 ,下列说法正确的是( )
,下列说法正确的是( )
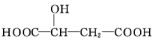 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸不能发生聚合反应 | |
| B. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| C. | 苹果酸分子的核磁共振氢谱有四组峰,峰面积之比为1:1:2:2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
16.下列实验不能作为判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 比较Mg(OH)2与Al(OH)3的碱性强弱,判断镁与铝的金属性强弱 | |
| C. | 往硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 根据HF和HCl的水溶液的酸性强弱判断氟与氯的非金属性的强弱 |
13.用电解尿素[CO(NH2)2]的碱性溶液制氢气的装置如图所示.下列说法错误的是( )


| A. | 为增强导电性,可用金属铜作阳极 | |
| B. | 电解过程中阴、阳极产生的气体物质的量之比为3:1 | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 阳极的电极反应式为:CO(NH2)2-6e-+8 OH-═CO32-+N2↑+6H2O |
20.短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素;Z原子的最外层电子数是其最内层电子数的$\frac{1}{2}$;W的最高正价和最低负价的代数和为0,下列说法正确的是( )
| A. | 原子半径:X<Y<Z<W | |
| B. | Z的氢化物中只含离子键 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |
4.下列有关化学键的叙述,正确的是( )
| A. | 仅含有共价键的物质定是共价化合物 | |
| B. | 单质分子中均存在化学键 | |
| C. | 离子化合物中一定含有离子键,可能含有配位键和共价键 | |
| D. | 由不同种非属元素的原子形成的共价化合物一定只含极性键 |

 .
.