题目内容
10.甲、乙、丙、丁、戊分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.(1)甲、丙均能与稀硫酸反应放出气体;(2)乙与丁的硝酸盐反应置换出单质丁;(3)丙与强碱反应放出气体;(4)丙、戊能被浓硫酸钝化.由此判断甲、乙、丙、丁、戊依次为( )| A. | Al、Cu、Mg、Ag、Fe | B. | Fe、Cu、Al、Ag、Mg | C. | Mg、Ag、Al、Cu、Fe | D. | Mg、Cu、Al、Ag、Fe |
分析 由(3)丙与强碱反应放出气体可知丙为Al,由金属活泼性及(1)、(4)可知甲为Mg,戊为Fe,以此来解答.
解答 解:只有Al与碱反应生成氢气,Fe、Al遇浓硫酸发生钝化,则由(3)丙与强碱反应放出气体可知丙为Al,由金属活泼性及(1)、(4)可知甲为Mg,戊为Fe,再由(2)乙与丁的硝酸盐反应置换出单质丁可知,丁为Ag,乙为Cu,
故选D.
点评 本题考查金属的性质,为高频考点,把握Al的特性、金属活泼性及发生钝化的金属为解答的关键,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
相关题目
20.下列物质互为同分异构体的是( )
| A. | 金刚石和石墨 | B. | 1H和2H | C. | 氯化氢和盐酸 | D. | 正丁烷和异丁烷 |
1.某溶液既能溶解Al(OH)3又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、CO32- | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Ag+、K+、NO3-、Na+ |
15.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 5.6 g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| B. | 1 mol NH3含有的电子数10NA | |
| C. | 常温常压下,22.4 L的氧气含氧原子数为2NA | |
| D. | 常温下,1 L0.1 mol•L-1AlCl3溶液中含Al3+数为0.1 NA |
2.关于下列四种有机物说法错误的是( )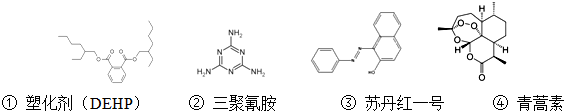

| A. | 塑化剂(DEHP)分子苯环上的二氯代物有六种不同的结构 | |
| B. | 三聚氰胺的分子式为C3N6H6 | |
| C. | 苏丹红一号分子中所有原子可能在同一平面上 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关 |
19.工业上用电解NaOH浓溶液的方法制备Na2FeO4,其工作原理如图所示.下列说法正确的是( )
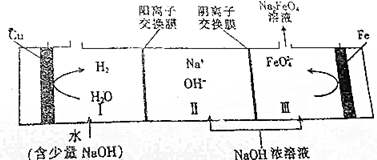

| A. | 电解时,铁棒连接电源的负极 | |
| B. | 铁棒的电极反应式为Fe+6e-+8OH-═FeO42-+4H2O | |
| C. | 若Ⅲ区生成1mol Na2FeO4,Ⅰ区将生成67.2L H2 | |
| D. | 电解总反应的离子方程式为Fe+2OH-+2H2O$\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑ |
12.纯碱属于( )
| A. | 氧化物 | B. | 酸 | C. | 碱 | D. | 盐 |

 .
. .
. ):
):
 、F
、F .
. 、⑨
、⑨ .
.