题目内容
15.利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如图所示: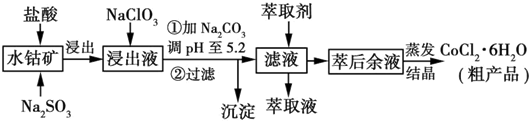
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将Fe2+氧化成Fe3+.
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图所示.萃取剂的作用是除去溶液中的Mn2+;其使用的适宜pH范围是B(填字母).
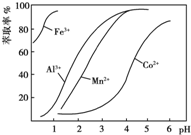
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去部分结晶水(任答一条即可).
分析 含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MnCl2,加入NaClO3氧化亚铁离子为铁离子,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2,然后加入萃取剂除去Mn2+等,萃取后溶液经过蒸发结晶得到CoCl2•6H2O.
(1)Co2O3与盐酸反应生成与CoCl2与水,Co3+将亚硫酸根氧化为硫酸根,自身被还原为Co2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+;
(3)加Na2CO3调pH至5.2所得沉淀为氢氧化铁、氢氧化铝;
(4)滤液Ⅱ中加入萃取剂的作用是除去锰离子,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(5)粗产品含有可溶性氯化物或晶体失去部分结晶水.
解答 解:含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MnCl2,加入NaClO3氧化亚铁离子为铁离子,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2,然后加入萃取剂除去Mn2+等,萃取后溶液经过蒸发结晶得到CoCl2•6H2O.
(1)Co2O3与盐酸反应生成与CoCl2与水,Co3+将亚硫酸根氧化为硫酸根,自身被还原为Co2+,反应离子方程式为:Co2O3+SO32-+4H+═2Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+═2Co2++SO42-+2H2O;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,以便后续步骤中调节溶液pH转化为氢氧化铁除去,
故答案为:将Fe2+氧化成Fe3+;
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(5)粗产品含有可溶性氯化物或晶体失去部分结晶水,使沉淀粗产品中CoCl2•6H2O的质量分数大于100%,
故答案为:粗产品含有可溶性氯化物或晶体失去部分结晶水.
点评 本题属于化学工艺流程题目,涉及物质分离和提纯、对操作与药品的分析评价、元素化合物知识、含量测定误差分析、信息获取与迁移运用等,关键是理解工艺流程,题目难度中等.

 优等生题库系列答案
优等生题库系列答案①适量的盐酸 ②适量的NaCl ③适量的醋酸 ④适量的CH3COONa.
| A. | ①② | B. | ③ | C. | ③④ | D. | ④ |
| A. | HNO3溶液 | B. | Ba(OH)2溶液 | C. | H2SO4溶液 | D. | HCl溶液 |
| A. | CaO | B. | NH4Cl | C. | H2O | D. | NaCl |
| A. | 蒸发 | B. | 萃取 | C. | 液体过滤 | D. | 升华 |
(1)制取H2和CO通常采用:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是AD.
A.该反应的反应物总能量小于生成物总能量
B.标准状况下,上述反应生成ILH2气体时吸收131.4kJ的热量
C.若CO(g)+H2(g)═C(s)+H2O(l)△H=-QkJ•mol-1,则Q<131.4
D.若C(s)+CO2(g)═2CO(g)△H1;CO(g)+H2O(g)═H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO.该反应为:CH4(g)+H2O(g)═CO(g)+3H2(g)
己知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
①0min~2min内H2的平均反应速率为0.18mol•L-1•min-1.
②达平衡时,CH4的转化率为20%.在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比变小(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有ad(填字母)
A.CO的含量保持不变 B.容器中c(CH4)与c(CO)相等
C.容器中混合气体的密度保持不变 D.3v正(CH4)=v逆(H2)
( 3 )合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如下图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过).

①a电极的名称为阳极.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=6Co2++CO2+6H+.
| A. | 酒精 | B. | 次氯酸 | C. | 苯酚 | D. | 甲醛 |
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 加热碳酸氢钠固体时,试管管口倾斜向上 | |
| C. | 实验室制取氯气时,用NaOH溶液进行尾气吸收 | |
| D. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
 某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.
某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.