题目内容
6.将10.8g 金属铝投入到400mL 2.0mol/L的某溶液中有氢气产生,充分反应后有金属剩余,则该溶液可能为( )| A. | HNO3溶液 | B. | Ba(OH)2溶液 | C. | H2SO4溶液 | D. | HCl溶液 |
分析 n(Al)=$\frac{10.8g}{27g/mol}$=0.4mol,400mL 2.0mol/L的某溶液中溶质的物质的量为2.0mol/L×0.4L=0.8mol,根据方程式中的比例判断Al过量,并生成氢气即可.
解答 解:A.Al与硝酸溶液反应不生成氢气,不符合题意,故A错误;
B.由2Al+2OH-+2H2O═2AlO2-+3H2↑,0.4molAl与0.8molBa(OH)2溶液反应时,碱过量,故B错误;
C.由2Al+6H+═2Al3++3H2↑,0.4molAl与0.8molH2SO4溶液,硫酸过量,故C错误;
D.由2Al+6H+═2Al3++3H2↑,0.2molAl与0.4molHCl溶液,Al过量,故D正确;
故选D.
点评 本题考查铝的化学性质,明确铝与酸碱发生的化学反应是解答的关键,难度中等,并注意利用量来判断过量问题即可解答.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
4.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②硝酸钠溶液 ③H2O ④CH3COONa 固体 ⑤硫酸钾溶液.
①NaOH固体 ②硝酸钠溶液 ③H2O ④CH3COONa 固体 ⑤硫酸钾溶液.
| A. | ①③⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
14. 氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
上述反应过程中能量转化形式为光能转化为化学能,达平衡过程中至少需要吸收光能为0.968kJ(保留三位小数).
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:则1mol N-H键断裂吸收的能量约等于391 kJ.
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/molN2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol则H2还原NO2生成水蒸气和氮气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol放电充电
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是 H2+2NiO(OH)?2Ni(OH)2.请由总反应式回答:
①电解质溶液应该是碱溶液(选填酸溶液、碱溶液),
②电池放电时,负极反应式为H2-2e-+2OH-=2H2O,
③外电路中每通过0.2NA个电子时,H2的质量理论上减小0.2g,
④电池工作时,电子由负极通过外电路流向正极(选填正、负).
 氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:则1mol N-H键断裂吸收的能量约等于391 kJ.
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/molN2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol则H2还原NO2生成水蒸气和氮气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol放电充电
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是 H2+2NiO(OH)?2Ni(OH)2.请由总反应式回答:
①电解质溶液应该是碱溶液(选填酸溶液、碱溶液),
②电池放电时,负极反应式为H2-2e-+2OH-=2H2O,
③外电路中每通过0.2NA个电子时,H2的质量理论上减小0.2g,
④电池工作时,电子由负极通过外电路流向正极(选填正、负).
11.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法.
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬. 具体流程如下:

有关离子完全沉淀的pH如下表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O.
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂最好为:BD(填序号);
A.Na2O2B.Ca(OH)2C.Ba(OH)2D.NaOH
此时调节溶液的pH范围在C(填序号)最佳.
A.12~14B.10~11C.6~8D.3~4
(3)将等体积的4.0×10-3mol•L-1的AgNO3和4.0×10-3mol•L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程.
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬. 具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂最好为:BD(填序号);
A.Na2O2B.Ca(OH)2C.Ba(OH)2D.NaOH
此时调节溶液的pH范围在C(填序号)最佳.
A.12~14B.10~11C.6~8D.3~4
(3)将等体积的4.0×10-3mol•L-1的AgNO3和4.0×10-3mol•L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程.
18.碳及其化合物有广泛的用途.
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为CH3OH(g)+H2O-6e-=CO2+6H+.
(4)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①其它条件不变,降低温度,达到新平衡前 v(逆)< v(正)(填“>”、“<”或“=”).
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1.
(3)CO与H2一定条件下反应生成甲醇(CH3OH),可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为CH3OH(g)+H2O-6e-=CO2+6H+.
(4)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
15.利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如图所示:
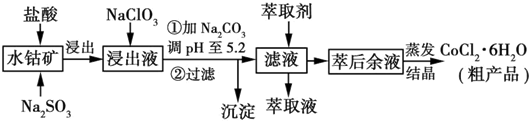
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+═2Co2++SO42-+2H2O.
(2)NaClO3的作用是将Fe2+氧化成Fe3+.
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图所示.萃取剂的作用是除去溶液中的Mn2+;其使用的适宜pH范围是B(填字母).
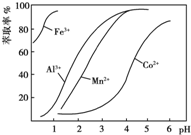
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去部分结晶水(任答一条即可).

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将Fe2+氧化成Fe3+.
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图所示.萃取剂的作用是除去溶液中的Mn2+;其使用的适宜pH范围是B(填字母).

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去部分结晶水(任答一条即可).