题目内容
4.药皂具有杀菌、消毒作用,通常是因为在普通肥皂中加入了适量的( )| A. | 酒精 | B. | 次氯酸 | C. | 苯酚 | D. | 甲醛 |
分析 一般的肥皂和香皂,都没有什么杀菌作用,但是有一种药皂,在制造这种药皂时,掺入了苯酚的成分,所以这种药皂是有一定的消毒杀菌作用的.
解答 解:在普通肥皂中加入了适量的苯酚制成了药皂,所以药皂具有杀菌、消毒作用,
故选C.
点评 本题主要考查了药皂的杀菌、消毒的原理,掌握酚的性质与应用是解题的关键,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案
相关题目
14. 氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
上述反应过程中能量转化形式为光能转化为化学能,达平衡过程中至少需要吸收光能为0.968kJ(保留三位小数).
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:则1mol N-H键断裂吸收的能量约等于391 kJ.
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/molN2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol则H2还原NO2生成水蒸气和氮气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol放电充电
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是 H2+2NiO(OH)?2Ni(OH)2.请由总反应式回答:
①电解质溶液应该是碱溶液(选填酸溶液、碱溶液),
②电池放电时,负极反应式为H2-2e-+2OH-=2H2O,
③外电路中每通过0.2NA个电子时,H2的质量理论上减小0.2g,
④电池工作时,电子由负极通过外电路流向正极(选填正、负).
 氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:则1mol N-H键断裂吸收的能量约等于391 kJ.
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/molN2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol则H2还原NO2生成水蒸气和氮气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol放电充电
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是 H2+2NiO(OH)?2Ni(OH)2.请由总反应式回答:
①电解质溶液应该是碱溶液(选填酸溶液、碱溶液),
②电池放电时,负极反应式为H2-2e-+2OH-=2H2O,
③外电路中每通过0.2NA个电子时,H2的质量理论上减小0.2g,
④电池工作时,电子由负极通过外电路流向正极(选填正、负).
15.利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如图所示:
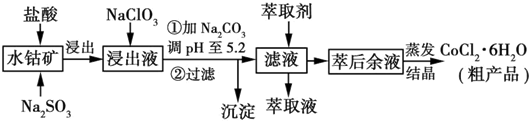
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+═2Co2++SO42-+2H2O.
(2)NaClO3的作用是将Fe2+氧化成Fe3+.
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图所示.萃取剂的作用是除去溶液中的Mn2+;其使用的适宜pH范围是B(填字母).
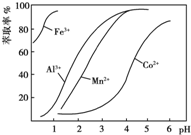
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去部分结晶水(任答一条即可).

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将Fe2+氧化成Fe3+.
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图所示.萃取剂的作用是除去溶液中的Mn2+;其使用的适宜pH范围是B(填字母).

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去部分结晶水(任答一条即可).
19.材料在生产和日常生活中有着广泛的应用.下列叙述正确的是( )
| A. | 玻璃钢是复合材料 | B. | 铝是黑色金属材料 | ||
| C. | 石英是半导体材料 | D. | 水泥是新型无机非金属材料 |
9.常温下加入下列物质,能使溶液中c(CO32-)、c(HCO3-)均降低,而pH增大的是( )
| A. | 氢氧化钠溶液 | B. | 通入二氧化碳 | C. | 氢氧化钙溶液 | D. | 盐酸 |
14.某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体.现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中正确的是( )
| A. | 肯定有SO2、NO、O2 | B. | 肯定没有C12、O2和NO2 | ||
| C. | 可能有Cl2和O2 | D. | 肯定只有NO |