题目内容
7.下列物质的转化在给定条件下能实现的是( )①NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3$\stackrel{△}{→}$Al2O3(熔融)$\stackrel{电解}{→}$Al$→_{高温}^{Fe_{2}O_{3}}$Fe
②S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4
③Cu2(OH)2CO3$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$Cu
④FeO3$\stackrel{HCl(aq)}{→}$FeCl3$\stackrel{△}{→}$无水FeCl3
⑤饱和NaCl(aq)$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3.
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
分析 ①NaAlO2溶液与CO2反应生成氢氧化铝沉淀;Al(OH)3受热分解变为Al2O3;Al2O3电解得到Al,Al与Fe2O3在高温下发生铝热反应产生Fe和Al2O3;
②S与氧气在点燃时反应产生SO2,而不能得到SO3;
③碱式碳酸铜与盐酸反应产生CuCl2,CuCl2溶液电解得到Cu和Cl2;
④Fe2O3与盐酸发生反应得到FeCl3和水,加热FeCl3溶液,得到的是Fe(OH)3;
⑤饱和NaCl溶液中通入NH3再通入CO2,会生成NaHCO3晶体,NaHCO3受热分解产生Na2CO3.
解答 解:①由于酸性碳酸强于Al(OH)3,所以向NaAlO2溶液中通入CO2,会发生反应:NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3.形成Al(OH)3沉淀;Al(OH)3不稳定,受热分解变为Al2O3、H2O;Al2O3是离子化合物,电解得到Al,Al与Fe2O3在高温下发生铝热反应产生Fe和Al2O3,故正确;
②S与氧气在点燃时反应产生SO2,而不能得到SO3,SO2与氧气在加热和催化剂的条件下反应生成SO3,故错误;
③碱式碳酸铜与盐酸反应产生CuCl2,CuCl2溶液电解得到Cu和Cl2,故正确;
④Fe2O3与盐酸发生反应得到FeCl3和水,FeCl3是强酸弱碱盐,水解产生Fe(OH)3、HCl,加热该物质的溶液,促进盐的水解,HCl逸出,得到的是Fe(OH)3,故错误;
⑤饱和NaCl溶液中通入NH3再通入CO2,会发生反应产生NaHCO3晶体,将其过滤出来,加热由于NaHCO3不稳定,受热分解产生Na2CO3,故正确.
故选A.
点评 本题考查化合物的性质,题目难度不大,熟练掌握物质的性质是解决此类问题的关键,正确运用物质之间的反应规律则是解决此类问题的有效方法.

 阅读快车系列答案
阅读快车系列答案| A. | 乙苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 糖、油脂、蛋白质都能发生水解反应 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
| A. | H×+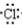 → →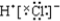 | B. | Na×+ → →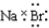 | ||
| C. |  | D. |  |
| A. | 肯定有A13+、Mg2+、NH4+、Cl- | B. | 肯定有Al3+、Mg2+、SO42- | ||
| C. | 肯定没有NH4+、HCO3-、MnO4- | D. | 肯定有Al3+、Mg2+、HCO3- |
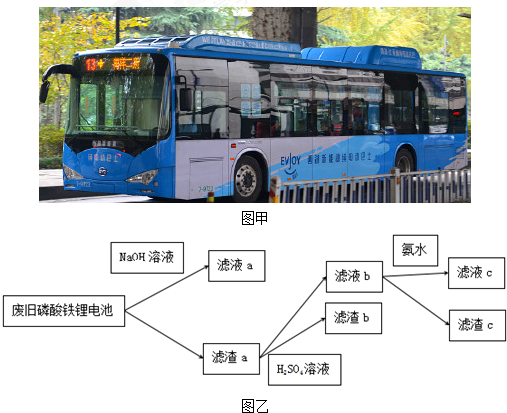
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |


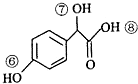 )的说法正确的是AD.
)的说法正确的是AD.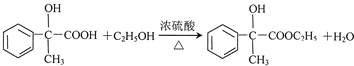 .
.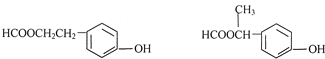 .
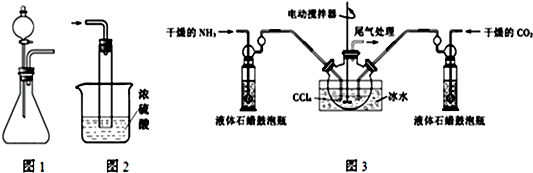
.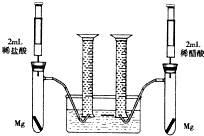 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图(夹持仪器略):
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图(夹持仪器略):