题目内容
12.下列用电子式表示的形成过程正确的是( )| A. | H×+ → → | B. | Na×+ → → | ||
| C. |  | D. |  |
分析 A.氯化氢是共价化合物,不能用中括号表示氯化氢的电子式;
B.溴化钠是离子化合物,应用中括号表示溴化钠的电子式;
C.氟化镁为离子化合物,镁离子应放在两个氟离子之间;
D.二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,C和O之间含有2个共用电子对.
解答 解:A.HCl为共价化合物,原子间以共用电子对成键,用电子式表示形成过程为 ,故A错误;
,故A错误;
B.溴化钠为离子化合物,钠离子与溴离子通过离子键结合,用电子式表示形成过程为 ,故B错误;
,故B错误;
C.氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为 ,故C错误;
,故C错误;
D.O原子和C原子通过共用电子对形成二氧化碳,所以其形成过程为 ,故D正确;
,故D正确;
故选:D.
点评 本题考查电子式以及用电子式表示形成过程,为高频考点,侧重于学生的化学用语的考查,注意相关知识的学习,把握书写方法,难度不大.

练习册系列答案
相关题目
1.草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加0.01mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10mL时,c(C2O42-)>c(Na+)>c(HC2O4-) |
2.下面不能由单质直接化合而得到的化合物( )
| A. | FeCl2 | B. | AlCl3 | C. | FeS | D. | Fe3O4 |
 2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.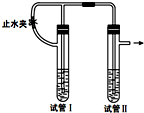 在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.
在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.
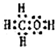 .
.