题目内容
19. 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图(夹持仪器略):
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图(夹持仪器略):实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积.
(1)盐酸与镁反应的离子方程式为Mg+2H+═Mg2++H2↑,.
(2)在上述实验方案中有一明显欠缺,该欠缺是没有说明两种酸的浓度相等.
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是盐酸的快,醋酸的慢;最终产生氢气体积的关系应是体积相等.
(4)实验中产生的氢气体积比理论值高,可能原因是反应放热,过量镁与水反应.
(5)通过比较起始反应的速率可以得出的结论是盐酸酸性比醋酸强.
(6)除上述方法外,还可以通过其他方向比较盐酸和醋酸的酸性,请写出其中的一种方法测定同浓度的盐酸和醋酸的pH或测定醋酸钠和氯化钠溶液的pH.
分析 (1)盐酸与镁反应生成氯化镁和氢气,反应的离子方程式为Mg+2H+═Mg2++H2↑;
(2)两种酸的浓度必须相等,才能比较反应速率快慢;
(3)醋酸为弱酸,溶液中只能部分电离出氢离子,则醋酸与镁的在开始时反应速率较小;由于两种酸的物质的量相等,则生成氢气的最终体积相等;
(4)该反应放热,过量镁与水反应生成了氢气;
(5)盐酸醋酸氢气速率快、醋酸慢,说明盐酸的酸性较强;
(6)比较酸的强弱,还可以测定相同浓度的醋酸和盐酸溶液的pH,或沉淀醋酸钠和氯化钠溶液的pH;
解答 解:(1)盐酸与镁反应生成氯化镁和氢气,反应的离子方程式为Mg+2H+═Mg2++H2↑,故答案为:Mg+2H+═Mg2++H2↑;
(2)根据产生氢气的速率判断酸性强弱时,必须指出醋酸和盐酸的浓度相等,否则无法比较,
故答案为:没有说明两种酸的浓度相等;
(3)醋酸为弱酸,盐酸为强酸,浓度相等时醋酸中氢离子浓度小于盐酸,则与镁的反应中,盐酸的快,醋酸的慢;由于醋酸和盐酸的浓度、体积相等,镁过量,则最终生成氢气的体积相等,
故答案为:盐酸的快,醋酸的慢; 体积相等;
(4)镁在加热条件下能够与水反应,所以该反应放热,导致过量镁与水反应生成氢气,所以产生的氢气比理论值高,
故答案为:反应放热,过量镁与水反应;
(5)根据醋酸、盐酸与镁反应产生氢气的速率可知,盐酸中氢离子浓度大于醋酸,则盐酸的酸性大于醋酸,
故答案为:盐酸酸性比醋酸强;
(6)判断醋酸和盐酸的酸性强弱,还可以通过测定同浓度的盐酸和醋酸的pH或测定醋酸钠和氯化钠溶液的pH进行判断,
故答案为:测定同浓度的盐酸和醋酸的pH;测定醋酸钠和氯化钠溶液的pH.
点评 本题考查了酸性强弱比较的方法,题目难度中等,明确弱电解质的电离平衡及其影响因素为解答关键,注意掌握判断酸性强弱的方法,试题培养了学生的分析能力及化学实验能力.

 金钥匙试卷系列答案
金钥匙试卷系列答案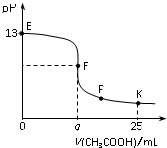 25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )| A. | a=12.5,且混合溶液pH=7 | |
| B. | 对应曲线上E、F之间的任何一点,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | |
| D. | K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| A. | 自然界中,不存在镁单质,碳元素多种单质 | |
| B. | CO可以还原氧化铜,Mg能还原CO2,反应类型均为置换反应 | |
| C. | 电解熔融氯化镁可制备Mg单质和氯气,海水提取海盐后的卤水可用于提取氯化镁 | |
| D. | 煤与水蒸气高温反应生成水煤气,其主要成分是CO和H2 |
| A. | 氡气在标准状况下密度约是19.8g•L-1 | |
| B. | 氡气化学性质较活泼,因此对人体有害 | |
| C. | “锕射气”是氡的同位素 | |
| D. | 氡原子核外有7个电子层,最外层有8个电子 |
| A. | Cl2>Fe3+>I2 | B. | Fe3+>Cl2>I2 | C. | Fe3+>I2>Cl2 | D. | Cl2>I2>Fe3+ |
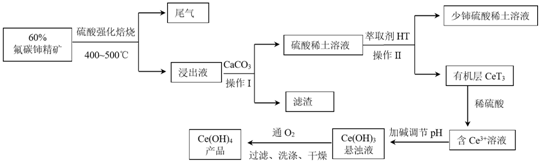
 用下面两种方法均可制得Fe(OH)2白色沉淀.
用下面两种方法均可制得Fe(OH)2白色沉淀. .
.