题目内容
1.已知反应AgF+Cl2+H2O→AgCl↓+AgClO3+HF+O2(未配平),每生成1.5molO2时,被还原的氯气的物质的量为6.75mol;当有2.4mol电子转移时,反应中被还原的Cl2的物质的量为1.2mol.分析 首先对化学方程式进行配平,被还原的Cl2的物质的量等于AgCl的物质的量的一半,转移电子的物质的量等于生成AgCl的物质的量.
解答 解:10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2,
被还原的氯气的物质的量等于AgCl的物质的量的一半,每生成1.5molO2时,同时生成AgCl的物质的量为1.5mol×$\frac{1}{2}$×9=6.75mol;
转移电子的物质的量等于生成AgCl的物质的量,当有2.4mol电子转移时,生成AgCl的物质的量是2.4mol,反应中被还原的Cl2的物质的量为2.4mol×$\frac{1}{2}$=1.2mol,
故答案为:6.75mol;1.2mol.
点评 本题考查氧化还原反应,明确元素的化合价变化是解答的关键,注意Cl的得电子数等于转移的电子总数,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列各组离子一定能大量共存的是( )
| A. | 在强碱性溶液中:Na+、K+、[Al(OH)4]-、CO32- | |
| B. | 在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在c(H+)=10-13mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
12.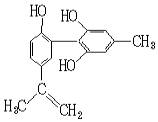 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 有机物分子式为C16H14O3 | |
| B. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| C. | 1 mol该物质分别与浓溴水、H2反应时最多消耗Br2和H2分别为4 mol、7 mol | |
| D. | 滴入KMnO4(H+)溶液,观察紫色褪去,可证明结构中存在碳碳双键 |
9.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4LC2H2、C2H6的混合气体与22.4LC2H4中所含原子总数均为6NA | |
| B. | 常温下,1L PH=14的NaOH溶液中由水电离出的OH-个数为NA | |
| C. | 标准状况下,11.2L的12C16O和14N2的混合气体中所含中子数和原子数的差值为6NA | |
| D. | 将200mL0.1mol•L-1FeCl3溶液制成胶体,所得Fe(OH)3胶体粒子数为0.02NA |
6.下列离子方程式正确的是( )
| A. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42-═MgSO4↓+2H2O | |
| C. | 镁与醋酸反应 Mg+2H+═Mg2++H2↑ | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
13.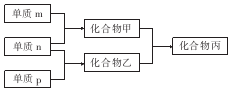 短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )
短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )
 短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )
短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )| A. | X是同周期中非金属性最强的元素 | |
| B. | 元素X、Y、Z的原子半径大小关系为X<Y<Z | |
| C. | Z的氧化物的水化物的酸性在主族元素中最强 | |
| D. | 化合物丙是离子化合物,既含离子键又含共价键 |
10.分子式为C7H6Cl2的芳香族化合物共有(不含立体异构体)( )
| A. | 6种 | B. | 9种 | C. | 10 种 | D. | 12 种 |
14.下列有关的判断或表示方法正确的是( )
| A. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1 | |
| B. | 中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验 | |
| C. | 在测定中和热的实验中,至少需要测定并记录的温度是3次 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |