题目内容
13. 短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )
短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )| A. | X是同周期中非金属性最强的元素 | |
| B. | 元素X、Y、Z的原子半径大小关系为X<Y<Z | |
| C. | Z的氧化物的水化物的酸性在主族元素中最强 | |
| D. | 化合物丙是离子化合物,既含离子键又含共价键 |
分析 常见双原子单质分子中,含共价键数目最多的是N2,即m为N2,分子中含有3个共价键,单质m、n、p在通常状况下均为气态,应为非金属,分别反应生成化合物甲、乙,甲分子含10个电子,乙分子含18个电子,则化合物甲为NH3,n为H2,乙为氢化物,含有18个电子,乙为HCl,则p为Cl2,丙为NH4Cl,可知X为N、Y为H,Z为Cl元素,以此解答该题.
解答 解:由以上分析可知X为N、Y为H,Z为Cl元素,
A.N位于第二周期,非金属性最强的为F元素,故A错误;
B.H为元素周期表中原子半径最小的原子,应为Y<X<Z,故B错误;
C.应为最高价氧化物的水化物,如不是最高价,则酸性不一定最强,故C错误;
D.化合物丙为氯化铵,为离子化合物,含有离子键和共价键,故D正确.
故选D.
点评 本题考查无机物的推断,为高考常见题型和高频考点,侧重考查学生的分析能力,题目难度不大,注意把握题中信息,认真审题,为解答该题的关键,注意元素周期率的递变规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.在下列条件下,两种气体的分子数一定相等的是( )
| A. | 同密度、同压强的CO和C2H4 | B. | 同温度、同体积的O2和N2 | ||
| C. | 同体积、同密度的C2H4和N2 | D. | 同压强、同体积的O2和N2 |
4.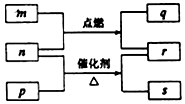 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )| A. | 原子半径:Y<X<Z | |
| B. | 简单氢化物沸点:X<Y<Z | |
| C. | m与q、n与s均不能共存 | |
| D. | W、X、Y、Z四种元素可组合成离子化合物 |
8.现有下列几个离子反应:
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
④Cl2+2Br-═Br2+2Cl-
下列有关性质的比较中正确的是( )
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
④Cl2+2Br-═Br2+2Cl-
下列有关性质的比较中正确的是( )
| A. | 氧化性:Cl2>Br2>Cr2O72- | B. | 氧化性:Cr2O72->Cl2>Fe3+ | ||
| C. | 还原性:SO2<Fe2+<Br- | D. | 还原性:Cl->Cr3+>Fe2+ |
6.下列说法中不正确的是( )
| A. | 1mol稀硫酸和1mol稀Ba(OH)2溶液完全中和所放出的热量为中和热 | |
| B. | 中和反应都是放热反应,盐类水解反应都是吸热反应 | |
| C. | 在101kPa时,1mol碳燃烧所放出的热量一定是碳的燃烧热 | |
| D. | 碳与二氧化碳的反应既是吸热反应,也是化合反应 |
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答:
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答: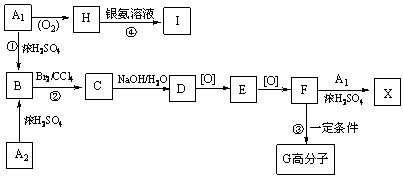
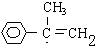 ; G
; G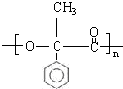 .反应C→D属于取代反应(填反应类型)
.反应C→D属于取代反应(填反应类型)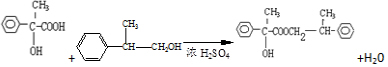 ;H→I反应的化学方程式
;H→I反应的化学方程式 .
.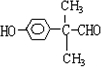 (任写一种即可).
(任写一种即可).