题目内容
16.化合物甲和NaAlH4都是重要的还原剂.一定条件下金属钠和H2反应生成甲.甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4.将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2请推测并回答:
(1)甲的化学式NaH.
(2)甲与AlCl3反应得到NaAlH4的化学方程式4NaH+AlCl3=NaAlH4+3NaCl.
(3)NaAlH4与水发生氧化还原反应的化学方程式NaAlH4+2H2O=NaAlO2+4H2↑.
(4)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的.
判断该同学设想的制备和验纯方法的合理性并说明理由制备过程不合理,因为盐酸易挥发,氢气中混有HCl,导致产物中有NaCl;验纯方法不合理,如果有Na残留,Na与水反应也产生氢气,且没有考虑混入的NaCl.
分析 金属钠和H2反应生成甲,则甲为NaH,具有还原性,可与水反应生成NaOH和氢气,
(1)甲为钠和氢气反应的产物,为NaH;
(2)NaH与AlCl3反应可得到NaAlH4;
(3)NaAlH4与水反应生成氢气,应是水中的H元素与NaH中的H元素之间得失电子;
(4)制备过程中未指明吸收杂质气体HCl,据此解答;氢气与金属钠反应未指明钠的用量,钠可能过量,过量的钠也可以与水反应生成氢气.
解答 解:(1)Na在化合价中呈现+1价,故该物质的化学式可能为NaH,又甲与AlCl3反应可得到NaAlH4,Al的化合价为+3,故H元素的化合价为-1,4.80g甲加热至完全分解,得到金属钠和2.24L,即0.1mol氢气,
化学反应方程式为:2NaH$\frac{\underline{\;加热\;}}{\;}$2Na+H2↑
48g 22.4L
4.8g 2.24L
故此化合物为NaH,
故答案为:NaH;
(2)NaH与AlCl3反应可得到NaAlH4,此反应无化合价的变化,根据原子守恒推测另一种生成物,化学反应方程式为:4NaH+AlCl3=NaAlH4+3NaCl,
故答案为:4NaH+AlCl3=NaAlH4+3NaCl;
(3)NaAlH4与水反应生成氢气,即NaH中H化合价升高,水中H元素化合价降低,化学反应方程式为:NaAlH4+2H2O=NaAlO2+4H2↑,
故答案为:NaAlH4+2H2O=NaAlO2+4H2↑;
(4)稀盐酸具有挥发性,且可以利用浓硫酸干燥,故制取的氢气中可能混有杂质气体HCl,那么制取的甲中就混有NaCl,验证过程中未排除金属钠的干扰,过量的金属能也可以与水反应生成氢气.
故答案为:制备过程不合理,因为盐酸易挥发,氢气中混有HCl,导致产物中有NaCl;验纯方法不合理,如果有Na残留,Na与水反应也产生氢气,且没有考虑混入的NaCl.
点评 本题主要考查的是常见元素以及其化合物的知识,为高频考点,和常见题型,综合性较强,涉及化学式的书写、物质的判断、氧化还原反应、化学反应方程式书写等,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

| A. | H-H=2H | B. | H2O(g)=H2O(l) | C. | H2+Cl2=2HCl | D. | NaOH (s)溶于水 |
| A. | K+、Na+、SO42-、NO3- | B. | Fe3+、A13+、Cl-、HS- | ||
| C. | Na+、A1O2-、Na+、HCO3- | D. | K+、Na+、MnO4-、NO3- |
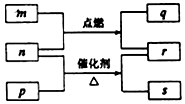 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )| A. | 原子半径:Y<X<Z | |
| B. | 简单氢化物沸点:X<Y<Z | |
| C. | m与q、n与s均不能共存 | |
| D. | W、X、Y、Z四种元素可组合成离子化合物 |
| A. | 镁和锌分别与相同浓度的盐酸反应,镁产生H2的速率快 | |
| B. | 铜与浓硝酸反应生成NO2,与稀硝酸反应生成NO | |
| C. | 面粉加工厂内充满粉尘遇火易发生爆炸 | |
| D. | 用加热的方法可以将水中溶解的O2和N2赶出 |
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
④Cl2+2Br-═Br2+2Cl-
下列有关性质的比较中正确的是( )
| A. | 氧化性:Cl2>Br2>Cr2O72- | B. | 氧化性:Cr2O72->Cl2>Fe3+ | ||
| C. | 还原性:SO2<Fe2+<Br- | D. | 还原性:Cl->Cr3+>Fe2+ |
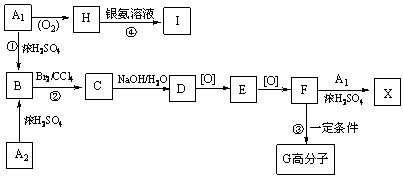
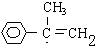 ; G
; G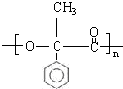 .反应C→D属于取代反应(填反应类型)
.反应C→D属于取代反应(填反应类型)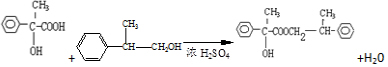 ;H→I反应的化学方程式
;H→I反应的化学方程式 .
.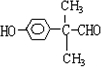 (任写一种即可).
(任写一种即可).