题目内容
12. 我国利用合成气直接制烯烃获重大突破,其原理是( )
我国利用合成气直接制烯烃获重大突破,其原理是( )反应①:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1
反应②:C(s)+H2O(g)?CO(g)+H2(g)△H2
反应③:CO(g)+2H2(g)?CH3OH(g)△H3=-90.1kJ•mol-1
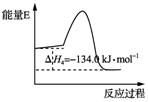
反应④:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H4,能量变化如图所示
反应⑤:3CH3OH(g)?CH3CH═CH2(g)+3H2O(g)△H5=-31.0kJ•mol-1
下列说法正确的是( )
| A. | 反应③使用催化剂,△H3减小 | |
| B. | 反应④中正反应的活化能大于逆反应的活化能 | |
| C. | △H1-△H2<0 | |
| D. | 3CO(g)+6H2(g)?CH3CH═CH2(g)+3H2O(g)△H=-121.1 kJ•mol-1 |
分析 A.催化剂不改变反应的始终态;
B.④为放热反应,焓变为正逆反应的活化能之差;
C.①-②得到H2(g)+$\frac{1}{2}$O2(g)?H2O(g),氢气燃烧放出热量;
D.③×3+⑤得到3CO(g)+6H2(g)?CH3CH═CH2(g)+3H2O(g).
解答 解:A.催化剂不改变反应的始终态,则反应③使用催化剂,△H3不变,故A错误;
B.④为放热反应,焓变为正逆反应的活化能之差,则反应④中正反应的活化能小于逆反应的活化能,故B错误;
C.①-②得到H2(g)+$\frac{1}{2}$O2(g)?H2O(g),氢气燃烧放出热量,则△H1-△H2<0,故C正确;
D.③×3+⑤得到3CO(g)+6H2(g)?CH3CH═CH2(g)+3H2O(g),△H=(-90.1kJ•mol-1)×3+(-31.0kJ•mol-1)=-301.3 kJ•mol-1,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,注意燃烧为放热反应及焓变与活化能的关系,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
7.短周期主族元素A、B、C、D的原子序数依次增大.A是周期表中原子半径最小的元素,B 是周期表中能形成化合物最多的元素,C2-和D3+离子的电子层结构相同.下列说法正确的是( )
| A. | 氢化物的稳定性:B>C | |
| B. | 氢化物的沸点:B>C | |
| C. | 最高价氧化物对应的水化物的酸性:B>D | |
| D. | A、B、C、D形成的单质最多有6 种 |
17.下列分子中,所有原子都处在同一平面的是( )
| A. | 环己烯 | B. | 丙烯 | C. | 乙烷 | D. | 氯乙烯 |
4.称取1.3060g氯化物试样,溶解后于250mL容量瓶中定容.取出25.00mL,以c(AgNO3)=0.1036mol/L的AgNO3溶液滴定,用去20.85mL.计算氯化物试样中氯的质量分数.
1.下列说法正确的是( )
| A. | 某烷烃的系统命名:3-甲基-2-乙基戊烷 | |
| B. | 氨基乙酸和硝基乙烷互为同分异构体 | |
| C. | 乙烯和1,3-丁二烯属于同系物CH3 | |
| D. | 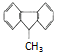 一氯代物有5种 一氯代物有5种 |
2.下列关于有机化合物的说法正确的是( )
| A. | 氯乙烯和溴乙烷均能发生加成反应 | |
| B. | 花生油和玉米油都是可皂化的饱和酯类 | |
| C. | 天然气和水煤气的主要成分都是烃类 | |
| D. | 分子式为C10H14的单取代芳烃,其可能的结构有4种 |