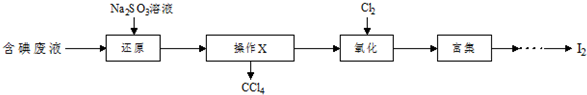
题目内容
2.在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体.(1)该过程的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是BC.

(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入过量的Ba(NO3)2溶液振荡,观察 | 现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3. |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入适量的NaOH溶液,振荡,观察 | 现象:有少量白色沉淀生成; 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中,先加入足量的稀硝酸,再加入少许AgNO3溶液振荡,观察 | 现象:有少量白色沉淀生成; 结论:试样中含有NaCl. |
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{a-\frac{84b}{31}}{a}$(用含a、b的代数式表示)
分析 (1)反应为侯氏制碱法原理,根据反应物和生成物可确定反应的方程式;
(2)加热固体,可在坩埚或试管中进行;
(3)纯碱制品含有Na2CO3和少量NaHCO3和NaCl,检验NaHCO3可用过量的Ba(NO3)2溶液先除去Na2CO3,然后加入NaOH溶液,如生成沉淀,可说明含有NaHCO3,过滤后加入硝酸酸化,加入硝酸银可检验NaCl;
(4)验方案是否可行,关键看根据测量数据能否计算出结果.
A、此方案利用碳酸氢钠的不稳定性,利用差量法即可计算质量分数;
B、根据钠守恒,可列方程组求解;
C、C项应先把水蒸气排除才合理;
D、根据质量关系,可列方程组求解.
取a克混合物充分加热,最后减重b克,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,结合方程式计算.
解答 解:(1)反应为侯氏制碱法原理,由反应物和生成物可知反应的方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(2)加热固体,可在坩埚或试管中进行,则BC符合,D试管口应向下倾斜,防止试管炸裂,故答案为:BC;
(3)纯碱制品含有Na2CO3和少量NaHCO3和NaCl,检验NaHCO3可用过量的Ba(NO3)2溶液先除去Na2CO3,然后加入NaOH溶液,如生成沉淀,可说明含有NaHCO3,原因是碳酸氢钠和氢氧化钠反应生成碳酸钠,碳酸钠和硝酸钡反应生成碳酸钡沉淀,过滤后加入硝酸酸化,加入硝酸银可检验NaCl,
故答案为:
| 过量的Ba(NO3)2溶液 | 试样中含有Na2CO3. |
| 适量的NaOH溶液 | 有少量白色沉淀生成. |
| 先加入足量的稀硝酸,再加入少许AgNO3溶液 | 有少量白色沉淀生成;试样中含有NaCl. |
B、反应后加热、蒸干、灼烧得到的固体产物是NaCl,Na2CO3和NaHCO3转化为NaCl时的固体质量变化不同,由钠元素守恒和质量关系,可列方程组计算,故B项成立;
C、C项中碱石灰可以同时吸收CO2和水蒸气,则无法计算,故C项错误;
D、Na2CO3和NaHCO3转化为BaCO3时的固体质量变化不同,利用质量关系来计算,故D项成立.
故答案为:C.
加热过程中碳酸钠不变,碳酸氢钠分解,反应的方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,反应前后固体质量变化为:bg,
则2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ 减少的固体质量△m
168 106 62
m(NaHCO3) bg
m(NaHCO3)=$\frac{168b}{62}$g=$\frac{84b}{31}$g,
则碳酸钠的质量分数为$\frac{a-\frac{84b}{31}}{a}$,
故答案为:$\frac{a-\frac{84b}{31}}{a}$.
点评 本题以碳酸钠的制备为载体,综合考查物质的制备和测定,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的原理和方法,结合反应的关系式进行计算,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 环己烯 | B. | 丙烯 | C. | 乙烷 | D. | 氯乙烯 |
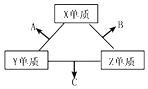 三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化.一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.下列判断正确的是( )
三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化.一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.下列判断正确的是( )| A. | 原子半径:Z<Y<X | B. | 非金属性 Z>Y>X | ||
| C. | 化合物A易溶于水 | D. | 化合物B与C的混合物呈碱性 |
| A. | c(ClO-)=1.0mol/L的溶液中:Na+、SO32-、S2-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液中:Ca2+、Mg2+、HCO3-、I- | |
| C. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- | |
| D. | 由水电离的c(H+)=1×10-12mol/L的溶液中:Ba2+、K+、Cl-、NO3- |
| A. | 氯乙烯和溴乙烷均能发生加成反应 | |
| B. | 花生油和玉米油都是可皂化的饱和酯类 | |
| C. | 天然气和水煤气的主要成分都是烃类 | |
| D. | 分子式为C10H14的单取代芳烃,其可能的结构有4种 |
| A. | 氯水中有下列平衡Cl2+H2O?HCl+HClO,光照后,溶液颜色变浅 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取较低的温度 | |
| C. | 用饱和食盐水除去Cl2中的HCl | |
| D. | 反应2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |