题目内容
5.往含有钠离子、铝离子、铵根离子、氯离子的酸性混合溶液中慢慢滴加氢氧化钠溶液至过量,根据实验现象写出相关的离子反应方程式:开始没有明显现象:H++OH-=H2O
接着出现白色沉淀:Al3++3OH-═Al(OH)3
沉淀达到最大后又开始没有明显现象:NH4++OH-═NH3•H2O
沉淀慢慢溶解直至消失:NH4++OH-═NH3•H2O.
分析 溶液呈酸性,加入氢氧化钠溶液,先发生中和反应,由于铝离子与氨水反应生成沉淀,则继续加入氢氧化钠,先和铝离子反应,再和铵根离子反应,以此解答该题.
解答 解:溶液呈酸性,加入氢氧化钠溶液,先发生中和反应,离子方程式为H++OH-=H2O,由于铝离子与氨水反应生成沉淀,则继续加入氢氧化钠,先和铝离子反应,发生Al3++3OH-═Al(OH)3,再和铵根离子反应,发生NH4++OH-═NH3•H2O,氢氧化钠过量时继续和氢氧化铝反应,沉淀溶解,发生NH4++OH-═NH3•H2O,
故答案为:H++OH-=H2O;Al3++3OH-═Al(OH)3;NH4++OH-═NH3•H2O;Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查离子方程式的书写,为高频考点,侧重学生分析能力以及元素化合物知识的综合理解和运用的考查,注意把握反应的先后顺序,把握物质的性质,难度中等.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
16.“绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放.下列反应类型一定符合这一要求的是( )
①取代反应 ②加成反应 ③水解反应 ④加聚反应 ⑤酯化反应.
①取代反应 ②加成反应 ③水解反应 ④加聚反应 ⑤酯化反应.
| A. | ②④ | B. | ②③ | C. | ④⑤ | D. | ①④ |
10.碳酸钠可用于制造玻璃,其俗称是( )
| A. | 小苏打 | B. | 熟石灰 | C. | 生石灰 | D. | 纯碱 |
17.以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型.下列分子都属于含极性键的非极性分子的是( )
| A. | CO2 H2O | B. | NH3 BCl3 | C. | PCl3 CH4 | D. | PCl5 CH4 |
15.下列反应过程中断键和成键能量变化符合下图所示的是( )
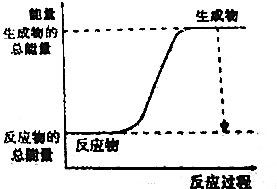

| A. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl | B. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
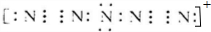 .
.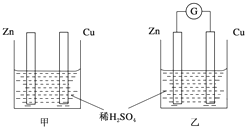 ①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题: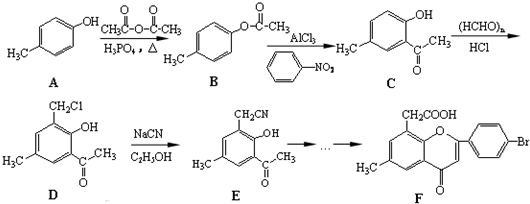
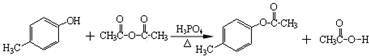 .
.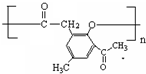 .
.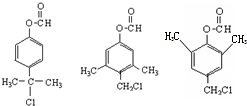 .
.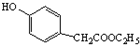 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下: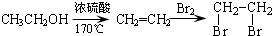
 .
. .
.