题目内容
6.已知:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1.现有该温度下的三个体积相同的密闭容器,在第一个容器中通入2mol SO2和1mol O2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1mol SO2、0.5mol O2和1mol SO3达到平衡时放出的热量为Q3.下列关系正确的是( )| A. | Q1=Q3=197 kJ | B. | Q1=Q3<197 kJ | C. | 2Q2=Q1<197 kJ | D. | 2Q2<Q1<197 kJ |
分析 2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,表示在上述条件下2mol SO2和1molO2完全反应生成1molSO3气体放出热量为197kJ;如果加入生成物,则平衡逆移,要吸收热量;再结合可逆反应中反应物不能完全反应解答.
解答 解:反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,
由热化学方程式可知,在上述条件下反应生成2molSO3气体放热197kJ,加入2mol SO2和1molO2,由于是可逆反应,所以生成的三氧化硫量小于2mol,所以Q1<197kJ,
通入1molSO2,0.5mol O2,如果转化率与加入2mol SO2和1molO2相同,则放热为0.5Q1kJ,但是此时体系压强比加入2mol SO2和1molO2要小,所以平衡会向左移动,所以实际放出的热量Q2<0.5Q1;
在1molSO2,0.5mol O2 的基础上再加1mol SO3,则平衡逆移,要吸收热量,所以通入1molSO2,0.5mol O2 和1mol SO3时实际放出的热量Q3<Q2;
综上得:Q3<Q2、2Q2<Q1<197 kJ•mol-1,
故选D.
点评 本题考查化学平衡的影响以及反应热的计算,为高频考点,侧重考查学生的分析能力以及对平衡移动的综合考查,题目难度中等,本题注意浓度对平衡的影响以及可逆反应的特征,要注意加入生成物对反应热量的影响.

练习册系列答案
相关题目
7.下列离子方程式正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+H+═H2O+CO2 | |
| B. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2 | |
| C. | 硝酸与氢氧化钡反应:OH-+H+═H2O | |
| D. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
17.配制一定物质的量浓度的氢氧化钠溶液,造成浓度偏高的操作是( )
| A. | 所用的氢氧化钠固体放置于空气中过久 | |
| B. | 定容时,眼睛俯视刻度线 | |
| C. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| D. | 定容后摇匀,发现液面低于刻度线,不作处理 |
14.钢铁因锈蚀每年造成大量的损失.钢铁在潮湿的空气中会发生电化学腐蚀,最普遍的正极反应是( )
| A. | 2H2O+O2+4e-=4OH- | B. | Fe-2e-=Fe2+ | ||
| C. | 2H++2e-=H2↑ | D. | Fe-3e-=Fe3+ |
1.下列实验操作中,错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 用100 mL容量瓶配制90mL1mol/L的NaOH溶液 | |
| C. | 用量筒量取5.65mL的浓硫酸 | |
| D. | 用托盘天平准确称取3.2gNaCl固体 |
18.25℃时,把0.2mol•L-1的醋酸加水稀释,则图中的纵轴y表示的是( )
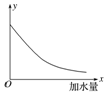

| A. | 溶液中OH-的物质的量浓度 | B. | 溶液的导电能力 | ||
| C. | 溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ | D. | CH3COOH的电离程度 |
16.根据下列实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作与现象 | 结论 |
| A | 向油脂皂化反应后的溶液中滴入酚酞,溶液变红 | 油脂已经完全皂化 |
| B | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,有光亮的银生成 | 蔗糖溶液已经水解完全 |
| C | 向溶液X中滴入NaHCO3溶液,产生无色气体 | X中的溶质一定是酸 |
| D | 向鸡蛋清溶液中滴加醋酸铅溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| A. | A | B. | B | C. | C | D. | D |
 .
.