题目内容
11.下列各项中物质的类别不正确的是( )| A | B | C | D |
| Al2O3 | Na2O2 | Si | Na2SiO3 |
| 两性氧化物 | 碱性氧化物 | 单质 | 硅酸盐 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.和酸碱反应生成盐和水的氧化物是两性氧化物;
B.和酸反应生成盐和水的氧化物为碱性氧化物;
C.同种元素组成的纯净物为单质;
D.含有硅酸根离子的盐属于硅酸盐.
解答 解:A.氧化铝和强酸强碱发生反应生成盐和水属于两性氧化物,故A正确;
B.和酸反应生成盐和水的氧化物为碱性氧化物,过氧化钠和酸反应生成盐、水和氧气,发生的是氧化还原反应,过氧化钠不是碱性氧化物,故B错误;
C.同种元素组成的纯净物为单质,Si是同种元素组成的硅单质,故C正确;
D.Na2SiO3含有硅酸根离子,属于硅酸盐,故D正确;
故选B.
点评 本题考查了物质分类、物质组成等知识点,主要是碱性氧化物、两性氧化物概念实质的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
1.关于实验室制备乙烯的实验,下列说法正确的是( )
| A. | 反应物是乙醇和过量的3mol/L硫酸的混和液 | |
| B. | 温度计插入反应溶液液面以下,以便控制温度在140℃ | |
| C. | 反应容器(烧瓶)中应加入少许瓷片 | |
| D. | 反应完毕先灭火再从水中取出导管 |
2.氯化亚铜晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化.氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如图.
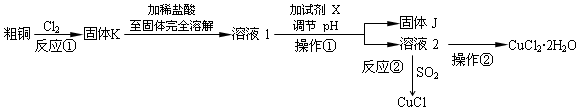
按要求回答下列问题:
(1)CuCl中Cu元素的化合价为+1价.操作②为加少量盐酸,蒸发浓缩、冷却结晶,过滤,洗涤,干燥
(2)溶液1可加试剂X用于调节pH,以除去杂质,试剂 X和固体J分别是c(填序号).
a.NaOH Fe(OH) b.NH3•H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-.
(4)实验室保存新制CuCl晶体的方法是避光、密封保存.
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.100mol•L-1硫酸铈标准溶液滴定.
已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+.
三次平行实验结果如表(平行实验结果相差不能超过1%):
则样品中CuCl的纯度为95.5%(结果保留三位有效数字).
(6)如图所示将氯气从a通入与粗铜反应(铁架台、铁夹、酒精灯省略),
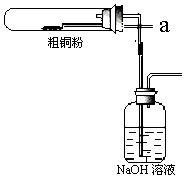
①反应时,盛粗铜粉的试管中的现象是产生大量棕黄色烟.
②反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该电化学腐蚀过程中的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.

按要求回答下列问题:
(1)CuCl中Cu元素的化合价为+1价.操作②为加少量盐酸,蒸发浓缩、冷却结晶,过滤,洗涤,干燥
(2)溶液1可加试剂X用于调节pH,以除去杂质,试剂 X和固体J分别是c(填序号).
a.NaOH Fe(OH) b.NH3•H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-.
(4)实验室保存新制CuCl晶体的方法是避光、密封保存.
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.100mol•L-1硫酸铈标准溶液滴定.
已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+.
三次平行实验结果如表(平行实验结果相差不能超过1%):
| 平行次数 | 1 | 2 | 3 |
| 0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
(6)如图所示将氯气从a通入与粗铜反应(铁架台、铁夹、酒精灯省略),

①反应时,盛粗铜粉的试管中的现象是产生大量棕黄色烟.
②反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该电化学腐蚀过程中的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.
6.已知:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1.现有该温度下的三个体积相同的密闭容器,在第一个容器中通入2mol SO2和1mol O2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1mol SO2、0.5mol O2和1mol SO3达到平衡时放出的热量为Q3.下列关系正确的是( )
| A. | Q1=Q3=197 kJ | B. | Q1=Q3<197 kJ | C. | 2Q2=Q1<197 kJ | D. | 2Q2<Q1<197 kJ |
20.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NH4HCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
①NH4HCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
| A. | ②③④ | B. | ②③④⑤ | C. | ①②③④ | D. | 全部 |
1.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)→2HCl(g)+Q1 ①; H2(g)+Br2(g)→2HBr(g)+Q2②有关上述反应的叙述错误的是( )
| A. | Ql>Q2 | |
| B. | 反应物总能量均高于生成物总能量 | |
| C. | 1molHBr(g)具有的能量大于1molHBr(l)具有的能量 | |
| D. | 反应①生成2 molHCl(l)时放出Q1热量 |
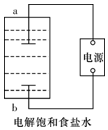 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载: