题目内容
11.碳族元素的单质及其化合物是一类重要物质.请回答下列问题: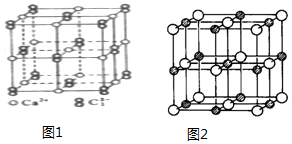
(1)锗(Ge)是用途很广的半导体材料,其基态电子排布式为[Ar]3d104s24p2.
(2)乙烯(C2H4)分子中六个原子在同一平面上,分子中碳原子的轨道杂化方式为sp2.
(3)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为原子晶体,该晶体中微粒间的作用力是共价键.
(4)可燃冰8CH4•46H2O是待开发的理想燃料,结构为笼状,其中能形成的氢键有1种.
(5)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为
 .
.(6)CaC2晶体的晶胞结构(如图1示)与NaCl晶体(如图2示)相似,但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.
图2中白色球表示Na+,则图中Na+的堆积方式为面心立方最密堆积.
分析 (1)Ge是32号元素,核外电子数为32,根据构造原理书写其基态原子核外电子排布式;
(2)乙烯(C2H4)分子每个C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式;
(3)原子晶体硬度较大,原子晶体中微粒间的作用力是共价键;
(4)可燃冰中只有水分子之间能形成氢键;
(5)等电子体的结构相似,故O22+的电子式与C22-的电子式相似;
(6)以最中心钙离子为例,Ca2+周围距离最近且等距离的C22-分布在这个钙离子同一层的正方形的棱边的中点上,由于晶胞沿一个方向拉长,所以上底面面心上和下底面面心上的两个C22-与钙离子的距离大于同一层上的4个C22-与钙离子的距离;
图2中白色球表示Na+,图中Na+位于晶胞的8个顶点、6个面上.
解答 解:(1)Ge是32号元素,核外电子数为32,基态原子核外电子排布式为:[Ar]3d104s24p2,
故答案为:[Ar]3d104s24p2;
(2)乙烯(C2H4)分子每个C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式为sp2,故答案为:sp2;
(3)氮化碳的硬度较大,说明氮化碳为原子晶体,氮化碳中存在共价键,
故答案为:原子晶体;共价键;
(4)可燃冰中只有水分子之间能形成氢键,所以只能形成一种氢键,
故答案为:1;
(5)根据等电子体原理可知,O22+的电子式  ,故答案为:
,故答案为: ;
;
(6)以最中心钙离子为例,Ca2+周围距离最近且等距离的C22-分布在这个钙离子同一层的正方形的棱边的中点上,由于晶胞沿一个方向拉长,所以上底面面心上和下底面面心上的两个C22-与钙离子的距离大于同一层上的4个C22-与钙离子的距离,所以1个Ca2+周围距离最近的C22-有4个,图2中白色球表示Na+,图中Na+位于晶胞的8个顶点、6个面上,属于面心立方最密堆积,
故答案为:4;面心立方最密堆积.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、电子式书写、氢键、原子杂化等知识点,侧重考查学生对物质结构、原子结构的认识及空间想象能力,掌握晶胞计算方法、价层电子对互斥理论,题目难度不大.

| A. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2SO2↑+2H2O | |
| B. | Cu+4NHO3(浓)=Cu(NO3)2+2NO2↑+2H2O | |
| C. | CH2=CH2+Br2→CH2Br-CH2Br | |
| D. | 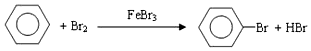 |
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=$\frac{3△{H}_{1}+2△{H}_{2}}{5}$.(请用含有△H1、△H2的式子表示)
(2)若NH3?$\frac{1}{2}$N2+$\frac{3}{2}$H2 K=a,则N2+3H2?2NH3 K′=$\frac{1}{{a}^{2}}$.(用含a的式子表示)
(3)在体积为3L的恒容密闭容器中,合成氨N2+3H2?2NH3实验,投入4mol N2和9mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则T1<T2(填“>”、“<”或“=”)
②在T2下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=0.1mol•L-1•min-1,平衡时N2的转化率α(N2)=25%.
③下列图象分别代表焓变(△H)、混合气体平均相对分子质量($\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是BC.
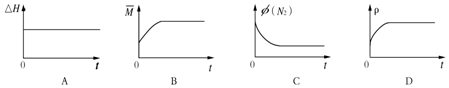
| A. | 等于0.6mol | B. | 等于1mol | ||
| C. | 大于0.6mol小于1mol | D. | 小于0.6mol |
| A. | 常温常压下,22.4 L CCl4、CO2含有的分子数为NA | |
| B. | 通常状况下,NA个CO2分子占有的体积约为22.4 L | |
| C. | 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |
| A. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 碳酸钙与稀硝酸的反应:CO32-+2H+═CO2+H2O | |
| C. | 铜与稀硫酸反应:Cu+2H+═Cu2++H2↑ | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+OH-═Cl-+ClO-+H2O |
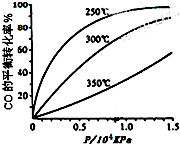 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.


