题目内容
13.15g A物质和10.5g B物质完全反应,生成7.2g C物质,1.8g D物质和0.3mol E物质,则E物质的摩尔质量是( )| A. | 100g/mol | B. | 100g | C. | 55g/mol | D. | 55g |
分析 先根据质量守恒定律来计算生成的E物质的质量,再利用M=$\frac{m}{n}$计算摩尔质量.
解答 解:15gA物质和10.5gB物质完全反应,生成7.2gC物质,1.8gD物质和0.3molE物质,
由质量守恒定律可知,反应前后的物质的质量和相等,
则E的质量为15g+10.5g-7.2g-1.8g=16.5g,
E的物质的量为0.3mol,
则E的摩尔质量为$\frac{16.5g}{0.3mol}$=55g/mol,
故选C.
点评 本题考查摩尔质量的计算,明确质量守恒定律的应用来计算E的质量是解答本题的关键,然后利用摩尔质量的概念即可解答.

练习册系列答案
相关题目
3.下列无色溶液中可以能大量共存的离子组是( )
| A. | Na+、NO3-、Cl- | B. | Cu2+、K+、NO3- | C. | H+、HCO3-、NO3- | D. | Na+、Ba2+、SO42- |
1.下列装置或操作能达到实验目的是( )
| A. |  实验室室制取并收集NH3 | B. |  构成铜锌原电池 | ||
| C. |  检查装置气密性 | D. |  利用排空气法收集CO2 |
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA | |
| B. | 1 mol-OH中电子数为10 NA | |
| C. | 4.2 g C3H6中含有的碳碳双键数一定为0.1 NA | |
| D. | 常温常压下,28 g丙烯和丁烯的混合气体中含有的碳原子数为2 NA |
5.已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和Ⅱ反应在不同温度时的平衡常数及其大小关系如表:
(1)①推测反应I是反应放热(填“吸热”或“放热”),②150oC时,反应Ⅲ的平衡常数表达式K=$\frac{{c}^{3}({O}_{2}){c}^{5}({N}_{2})}{{c}^{4}(N{H}_{3}){c}^{6}(N{O}_{2})}$,温度升高,K值增大(填“增大”或“减小”).
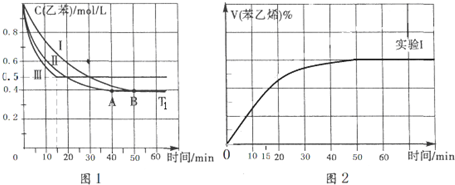
(2)相同条件下,反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①算0~4分钟在A催化剂作用下,反应速率V(NO)=0.375mol•L-1•min-1,
②下列说法不正确的是CE.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.反应达到平衡后,升高温度,逆反应速率先增大后减小
E.由如图1可知,催化剂A使反应进行的程度更大
(3)工业生产的尾气处理中,应用了反应Ⅲ的原理,如图2测得不同温度下氨气的转化率
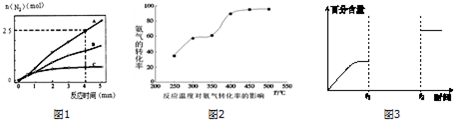
你认为反应控制的最佳温度应为C,
A.300~350℃B.350~400℃
C.400~450℃D.450~500℃
(4)某一体积固定的密闭容器中进行反应Ⅲ,200℃时达平衡.请在如图3补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,N2的百分含量随时间变化图象.
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和Ⅱ反应在不同温度时的平衡常数及其大小关系如表:
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①算0~4分钟在A催化剂作用下,反应速率V(NO)=0.375mol•L-1•min-1,
②下列说法不正确的是CE.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.反应达到平衡后,升高温度,逆反应速率先增大后减小
E.由如图1可知,催化剂A使反应进行的程度更大
(3)工业生产的尾气处理中,应用了反应Ⅲ的原理,如图2测得不同温度下氨气的转化率

你认为反应控制的最佳温度应为C,
A.300~350℃B.350~400℃
C.400~450℃D.450~500℃
(4)某一体积固定的密闭容器中进行反应Ⅲ,200℃时达平衡.请在如图3补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,N2的百分含量随时间变化图象.
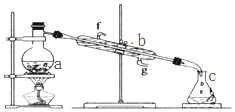 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.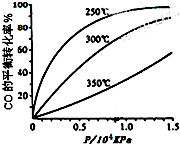 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义. +CO2(g)?
+CO2(g)? +CO(g)+H2O(l)△H
+CO(g)+H2O(l)△H ?
?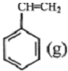 +H2(g)△H1=-125kJ/mol
+H2(g)△H1=-125kJ/mol