题目内容
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
| A、正极反应式为:O2+2H2O+4e-=4OH- |
| B、工作一段时间后,电解液中KOH的物质的量不变 |
| C、该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D、用其作电源电解精炼铜时,纯铜作阳极,而在镀件上电镀铜时金属铜作阴极 |
考点:化学电源新型电池
专题:电化学专题
分析:KOH溶液为电解液的氢氧燃料电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,结合电极反应解答该题.
解答:
解:A.通入氢气的一极为电池的负极,发生氧化反应,电极反应式为2H2-4e-+4OH-=4H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故A正确;
B.工作一段时间后,电池中生成水,溶液体积增大,电解液中KOH的物质的量浓度减小,依据电极反应可知,物质的量不变,故B正确;
C.正极反应为O2+2H2O+4e-=4OH-,负极反应为H2-2e-+2OH-=2H2O,则总反应式为:2H2+O2=2H2O,故C正确;
D.电解精炼铜时,粗铜作阳极,纯铜作阴极;在镀件上电镀铜时金属铜作阳极,待镀金属作阴极,故D错误;
故选D.
B.工作一段时间后,电池中生成水,溶液体积增大,电解液中KOH的物质的量浓度减小,依据电极反应可知,物质的量不变,故B正确;
C.正极反应为O2+2H2O+4e-=4OH-,负极反应为H2-2e-+2OH-=2H2O,则总反应式为:2H2+O2=2H2O,故C正确;
D.电解精炼铜时,粗铜作阳极,纯铜作阴极;在镀件上电镀铜时金属铜作阳极,待镀金属作阴极,故D错误;
故选D.
点评:本题考查原电池和电解池的工作原理,题目难度中等,解答该题的关键是把握原理,能正确书写电极反应式.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列现象或事实可用同一原理解释的是( )
| A、铁分别加入浓硫酸和氢氧化钠溶液中均无明显现象 |
| B、H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率 |
| C、漂白粉溶液和硅酸钠溶液久置空气中都变质 |
| D、SO2既能使品红褪色也能使酸性高锰酸钾褪色 |
将标准状况下的甲烷11.2L与22.4L O2混合后点燃,恢复到原状况时,气体的体积为( )
| A、11.2 L |
| B、33.6 L |
| C、22.4 L |
| D、44.8 L |
在下列有关晶体的叙述中正确的是( )
| A、晶体中有阳离子就一定存在阴离子 |
| B、分子晶体中一定存在共价键和分子间作用力 |
| C、金属晶体的熔点一定比分子晶体高 |
| D、原子晶体中,一定只存在共价键 |
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有( )试剂的洗气瓶.
| A、澄清石灰水,浓H2SO4 |
| B、KMnO4酸性溶液,浓H2SO4 |
| C、浓H2SO4,KMnO4酸性溶液 |
| D、溴水,烧碱溶液,浓硫酸 |
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)n(B)的变化关系.则下列结论正确的是( )


| A、200℃时,反应从开始到平衡的平均速率v(B)=0.04mol?L-1?min-1 |
| B、图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 |
| C、若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) |
| D、200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50% |
已知34Se和35Br位于同一周期,下列关系正确的是( )
| A、原子半径:Br>Se>Cl |
| B、热稳定性:HCl>H2Se>HBr |
| C、酸性:H2SeO4>HBrO4>HClO4 |
| D、还原性:Se2->Br->Cl- |
根据热化学方程式:S(g)+O2(g)?SO2(g)△H=-QkJ?mol-1(Q>0),下列分析正确的是( )
| A、1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出QkJ的热量 |
| B、1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
| C、S(s)+O2(g)?SO2(g)△H<-Q kJ?mol-1 |
| D、1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ |
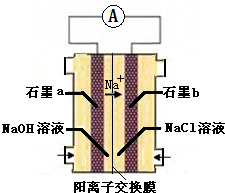 A、B、C、D是中学化学常见的四种物质,它们的转化关系如下:A+B=C+D
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下:A+B=C+D 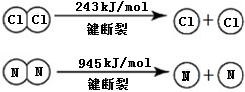 断开1mol H-N键与断开1mol H-Cl键所需能量相差约为
断开1mol H-N键与断开1mol H-Cl键所需能量相差约为