题目内容
已知34Se和35Br位于同一周期,下列关系正确的是( )
| A、原子半径:Br>Se>Cl |
| B、热稳定性:HCl>H2Se>HBr |
| C、酸性:H2SeO4>HBrO4>HClO4 |
| D、还原性:Se2->Br->Cl- |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:元素周期表中,同一周期元素从左到右,原子半径逐渐减小,非金属性逐渐增强,金属性逐渐减弱,元素的非金属性越强,对应的氢化物越稳定,最高价氧化物对应的水化物的酸性越强,阴离子的还原性越弱,以此解答.
解答:
解:B.非金属性:Cl>Br>Se,元素的非金属性越强,对应的氢化物越稳定,HCl>HBr>H2Se,故B错误;
A.同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则应有Se>Br>Cl,故A错误;
C.非金属性Cl>Br>Se,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性HClO4>HBrO4>H2SeO4,故C错误;
D.非金属性Cl>Br>Se,元素的非金属性越强,对应的阴离子的还原性越弱,则还原性Se2->Br->Cl-,故D正确.
故选D.
A.同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则应有Se>Br>Cl,故A错误;
C.非金属性Cl>Br>Se,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性HClO4>HBrO4>H2SeO4,故C错误;
D.非金属性Cl>Br>Se,元素的非金属性越强,对应的阴离子的还原性越弱,则还原性Se2->Br->Cl-,故D正确.
故选D.
点评:本题考查元素周期律知识,侧重于学生的分析能力的考查,为高考常见题型,注意把握元素的性质与对应单质、化合物的关系,难度不大.

练习册系列答案
相关题目
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
| A、正极反应式为:O2+2H2O+4e-=4OH- |
| B、工作一段时间后,电解液中KOH的物质的量不变 |
| C、该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D、用其作电源电解精炼铜时,纯铜作阳极,而在镀件上电镀铜时金属铜作阴极 |
60 27 |
60 27 |
| A、是一种核素 | ||
| B、质子数是60 | ||
C、与
| ||
| D、中子数是33 |
已知:25℃,101KPa下,固体白磷、固体红磷分别充分燃烧,放出热量如下:
①P(s,白磷)+
O2(g)=
P4O10(s) 放出755.2kJ的热
②P(s,红磷)+
O2(g)=
P4O10(s) 放出738.5kJ的热
据此判断下列说法中正确的是( )
①P(s,白磷)+
| 5 |
| 4 |
| 1 |
| 4 |
②P(s,红磷)+
| 5 |
| 4 |
| 1 |
| 4 |
据此判断下列说法中正确的是( )
| A、由白磷变红磷是吸热反应 |
| B、白磷、红磷都是磷的单质,相互可以自由转化,不吸热,也不放热 |
| C、等质量时,白磷比红磷具有的能量高 |
| D、等物质的量时,断白磷分子中的键比断红磷分子中的键消耗的能量多 |
常温下列各组离子在指定溶液中可能大量共存的是( )
| A、含有大量ClO-的溶液:Na+、OH-、I-、SO32- |
| B、澄清透明的溶液:Cu2+、Fe3+、NO3-、Cl- |
| C、使pH试纸变蓝的溶液:NH4+、K+、S2-、CO32- |
D、c( )=0.1mol/L的溶液:Na+、Cl-、CO32-、NO3- )=0.1mol/L的溶液:Na+、Cl-、CO32-、NO3- |
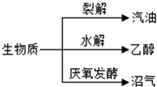 生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )| A、沼气的主要成分是甲烷 |
| B、汽油属于一次能源 |
| C、乙醇属于可再生能源 |
| D、生物质能来源于太阳能 |
下列各组顺序的排列不正确的是( )
| A、离子半径:Na+>Mg2+>Al3+>F- |
| B、热稳定性:HCl>H2S>PH3 |
| C、酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4 |
| D、熔点:SiO2>NaCl>Na>CO2 |
已知一定条件下,CO2 和CO的混合气体对氢气的相对密度是20,则CO2 和CO的质量比为( )
| A、1:3 | B、33:7 |
| C、3:1 | D、7:33 |