题目内容
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)n(B)的变化关系.则下列结论正确的是( )


| A、200℃时,反应从开始到平衡的平均速率v(B)=0.04mol?L-1?min-1 |
| B、图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 |
| C、若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) |
| D、200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50% |
考点:物质的量或浓度随时间的变化曲线,产物的百分含量随浓度、时间的变化曲线
专题:化学平衡专题
分析:A.由图Ⅰ可知,200℃时平衡时,B的物质的量变化量为0.4mol-0.2mol,根据v=
计算v(B);
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,据此判断反应热效应;在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,由图Ⅰ判断200℃时A、B的起始物质的量,据此计算a的值;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移;
D.200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,根据图Ⅰ中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,据此判断增大压强平衡移动方向.
| ||
| △t |
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,据此判断反应热效应;在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,由图Ⅰ判断200℃时A、B的起始物质的量,据此计算a的值;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移;
D.200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,根据图Ⅰ中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,据此判断增大压强平衡移动方向.
解答:
解:A.由图Ⅰ可知,200℃时5min达到平衡,平衡时B的物质的量变化量为0.4mol-0.2mol=0.2mol,故v(B)=
=0.02 mol?L-1?min-1,故A错误;
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0,图Ⅰ可知,200℃时平衡时,A的物质的量变化量为0.8mol-0.4mol=0.4mol,B的物质的量变化量为0.2mol,在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比=0.4mol:0.2mol=2,故B错误;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动,故v(正)=v(逆),故C错误;
D.由图Ⅰ可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4mol、0.2mol、0.2mol,物质的量之比等于化学计量数之比,故x:y;z=0.4mol:0.2mol:0.2mol=2:1:1,平衡时A 的体积分数为
=0.5,200℃时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,A的增大,故达到平衡时,A 的体积分数小于0.5,故D正确;
故选D.
| ||
| 5min |
B.由图Ⅱ可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0,图Ⅰ可知,200℃时平衡时,A的物质的量变化量为0.8mol-0.4mol=0.4mol,B的物质的量变化量为0.2mol,在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比=0.4mol:0.2mol=2,故B错误;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动,故v(正)=v(逆),故C错误;
D.由图Ⅰ可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4mol、0.2mol、0.2mol,物质的量之比等于化学计量数之比,故x:y;z=0.4mol:0.2mol:0.2mol=2:1:1,平衡时A 的体积分数为
| 0.4mol |
| 0.4mol+0.2mol+0.2m0l |
故选D.
点评:本题考查化学平衡图象、反应速率计算、影响化学平衡的因素、化学平衡有关计算等,难度中等,注意B选项中理解稀有气体对化学平衡移动的影响.

练习册系列答案
相关题目
甲、乙两种金属元素:①与稀盐酸反应,甲比乙反应剧烈;②甲原子能与乙的阳离子发生置换反应;③甲的最高价氧化物对应的水化物碱性比乙的最高价氧化物对应的水化物碱性强;④甲与乙用导线连接浸入稀硫酸形成原电池,电流由乙到甲;⑤甲单质的熔沸点比乙的低.能说明甲的金属性比乙强的是( )
| A、只有②③ |
| B、只有②③⑤ |
| C、只有①②③④ |
| D、①②③④⑤ |
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
| A、正极反应式为:O2+2H2O+4e-=4OH- |
| B、工作一段时间后,电解液中KOH的物质的量不变 |
| C、该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D、用其作电源电解精炼铜时,纯铜作阳极,而在镀件上电镀铜时金属铜作阴极 |
食品抗氧化剂是能阻止或延缓食品氧化变质、提高食品稳定性和延长贮存期的食品添加剂.BHT是一种常用的食品抗氧化剂,合成方法有如下两种:

下列说法不正确的是( )

下列说法不正确的是( )
A、 与BHT为同系物 与BHT为同系物 |
B、 能发生氧化反应 能发生氧化反应 |
| C、BHT不能与NaHCO3溶液反应生成CO2 |
| D、两种方法的反应类型都是加成反应 |
60 27 |
60 27 |
| A、是一种核素 | ||
| B、质子数是60 | ||
C、与
| ||
| D、中子数是33 |
已知:25℃,101KPa下,固体白磷、固体红磷分别充分燃烧,放出热量如下:
①P(s,白磷)+
O2(g)=
P4O10(s) 放出755.2kJ的热
②P(s,红磷)+
O2(g)=
P4O10(s) 放出738.5kJ的热
据此判断下列说法中正确的是( )
①P(s,白磷)+
| 5 |
| 4 |
| 1 |
| 4 |
②P(s,红磷)+
| 5 |
| 4 |
| 1 |
| 4 |
据此判断下列说法中正确的是( )
| A、由白磷变红磷是吸热反应 |
| B、白磷、红磷都是磷的单质,相互可以自由转化,不吸热,也不放热 |
| C、等质量时,白磷比红磷具有的能量高 |
| D、等物质的量时,断白磷分子中的键比断红磷分子中的键消耗的能量多 |
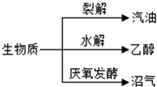 生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )| A、沼气的主要成分是甲烷 |
| B、汽油属于一次能源 |
| C、乙醇属于可再生能源 |
| D、生物质能来源于太阳能 |
下列除去杂质的方法正确的是( )
| A、除去氨气中的水蒸气:气体通过装有浓硫酸的洗气瓶 |
| B、除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 |
| C、除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| D、除去Cu粉中混有的CuO:加适量稀硝酸后,过滤.洗涤 |
 I.Fe2+和I-是两种常见的还原性离子.
I.Fe2+和I-是两种常见的还原性离子.