题目内容
1.从滴定管中滴下1滴溶液的体积接近( )| A. | 0.5mL | B. | 0.1mL | C. | 0.05mL | D. | 0.01mL |
分析 滴定管的0刻度在上方,从上到下刻度依次减小,从滴定管中滴下20-25滴溶液体积为1mL,据此解答.
解答 解:滴定管的刻度从上到下依次减小,0刻度在上方,从滴定管中滴下20-25滴溶液体积为1mL,所以从滴定管中滴下1滴溶液的体积接近0.05 mL,
故选C.
点评 本题考查常见仪器的构造及使用方法,题目难度不大,掌握从滴定管中滴下20-25滴溶液体积为1mL即可解答,注意明确常见仪器的构造,试题培养了学生的化学实验能力.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案
相关题目
11.X、Y、Z、W是原子序数依次增大的三个不同短周期主族元素.X、W均为所在周期数和族序数相等的元素.Y、Z易形成质量比为7:8和7:16的两种常见化合物.下列说法正确的是( )
| A. | 原子半径:Y<Z<W | |
| B. | 原子最外层电子数:W>Z>Y | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 由X、Y、Z三种元素形成的化合物的水溶液一定显酸性 |
12.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 1mol甲基(CH3-)所含的电子数为10NA | |
| B. | 46g由NO2和N2O4组成的混合气体中,含有的原子总数为3NA | |
| C. | 常温常压下,1mol分子式为C2H6O的有机物中,含有C-O键的数目为NA | |
| D. | 标准状次下产22.4L四氯化碳中含有C-Cl键的数目为4NA |
9.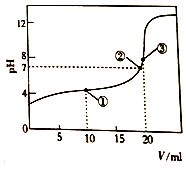 298K时,向20.00mL0.1mol/LHR溶液中滴加等浓度的NaOH 溶液,反应后溶液的pH与滴加的NaOH 溶液体积(V)的关系如图所示.下列说法正确的是( )
298K时,向20.00mL0.1mol/LHR溶液中滴加等浓度的NaOH 溶液,反应后溶液的pH与滴加的NaOH 溶液体积(V)的关系如图所示.下列说法正确的是( )
 298K时,向20.00mL0.1mol/LHR溶液中滴加等浓度的NaOH 溶液,反应后溶液的pH与滴加的NaOH 溶液体积(V)的关系如图所示.下列说法正确的是( )
298K时,向20.00mL0.1mol/LHR溶液中滴加等浓度的NaOH 溶液,反应后溶液的pH与滴加的NaOH 溶液体积(V)的关系如图所示.下列说法正确的是( )| A. | HR溶液中只含有一种分子和三种离子 | |
| B. | 在①②③点对于的溶液中,②点水的电离程度最大 | |
| C. | ③点对应的溶液中有c(R-)>c(Na+)>c(H+)>c(OH-) | |
| D. | ①点对应的溶液中R-的水解程度小于HR的电离程度 |
16.含有非极性共价键的离子化合物是( )
| A. | HC≡CH | B. | KOH | C. | Na2O2 | D. | CaCl2 |
6.已知CH3COOH与CH3COONa两种溶质1:1的混合稀溶液呈酸性.该溶液中三种微粒浓度排序正确的是( )
| A. | c(CH3COO-)>c(Na+)>c(CH3COOH) | B. | c(CH3COOH)>c(Na+)>c(CH3COO-) | ||
| C. | c(Na+)>c(CH3COO-)>c(CH3COOH) | D. | c(CH3COO-)>c(CH3COOH)>c(Na+) |
13.某同学用如图所示装置进行氨碱法制取纯碱的主要反应.下列说法合理的是( )
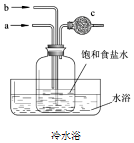

| A. | 先从b管通入NH3再从a管通入CO2 | B. | 先从a管通入CO2再从b管通入NH3 | ||
| C. | 广口瓶内有白色沉淀析出 | D. | c中试剂为碱石灰 |
10.在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )


| A. | H2R是二元弱酸,其Ka1=1×10-2 | |
| B. | NaHR在溶液中水解程度小于电离程度 | |
| C. | pH<7.2的溶液中一定存在:c( Na+)>c( HR-)>c(R2-)>c(H+)>c(OH-) | |
| D. | 含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |