题目内容
10.同温同压下,相同体积的N2和CO2,分子数比值为1:1;物质的量的比值1:1; 原子总数之比为2:3; 质量之比为7:11; 密度之比为7:11.分析 根据阿伏加德罗定律可知,同温同压下同体积的N2和CO2的物质的量相同,根据分子的组成和分子的相对分子质量计算粒子个数以及质量、密度等关系.
解答 解:根据阿伏加德罗定律可知,同温同压下同体积的N2和CO2的物质的量相同,物质的量之比为1:1;
设N2和CO2的物质的量都为1mol,
则根据N=n•NA可知:气体的分子数之比等于物质的量之比,为1:1;
1个CO2中含有3个原子,1个N2中含有2个原子,则原子数之比=1×2:(1×3)=2:3;
1molN2的质量为:1mol×28g/mol=28g,1molCO2的质量为:1mol×44g/mol=44g,N2和CO2的质量之比为28:44=7:11;
因N2和CO2的体积相同,则密度之比等于质量之比=7:11,
故答案为:1:1;1:1;2:3;7:11;7:11.
点评 本题考查阿伏加德罗定律及其推论,题目难度不大,明确物质的量与其它物理量之间的关系即可解答,注意相关计算公式的运用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
1.从滴定管中滴下1滴溶液的体积接近( )
| A. | 0.5mL | B. | 0.1mL | C. | 0.05mL | D. | 0.01mL |
1.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下方案.
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1mol H2C2O4转移2mol电子.写出H2C2O4与酸性KMnO4溶液反应的离子方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O.
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=0.010或1.0×10-2mol•L-1•min-1.
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=0.010或1.0×10-2mol•L-1•min-1.
15.为了提纯下列物质(括号内为杂质),所选除杂试剂,分离方法,必用仪器都正确的是( )
| 选项 | 不纯物质 | 除杂试剂 | 分离方法 | 必用仪器 |
| A | 碘(水) | 四氯化碳 | 萃取 | 分液漏斗 |
| B | 氯化钾(氯化钙) | 适量盐酸 | 过滤 | 玻璃棒 |
| C | 硝酸铜(硝酸银) | 适量铜粉 | 结晶 | 酒精灯 |
| D | 硫酸钾(碳酸钾) | 适量盐酸 | 蒸馏 | 温度计 |
| A. | A | B. | B | C. | C | D. | D |
2. 将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是( )
将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是( )
 将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是( )
将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是( )| A. | OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3- | |
| B. | A点溶液中的溶质为NaCl、NaHCO3 | |
| C. | 混合物中NaOH的质量0.60 g | |
| D. | 当加入35 mL盐酸时,产生CO2的体积为224 mL |
19.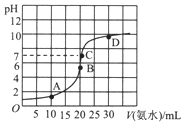 常温下,向20ml浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,pH随氨水体积的变化如图.下列说法不正确的是( )
常温下,向20ml浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,pH随氨水体积的变化如图.下列说法不正确的是( )
 常温下,向20ml浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,pH随氨水体积的变化如图.下列说法不正确的是( )
常温下,向20ml浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,pH随氨水体积的变化如图.下列说法不正确的是( )| A. | 在B点时:c(H+)=c(OH-)+c(NH3•H2O) | |
| B. | 在C点时:c(Cl-)<c(NH4+)+c(NH3•H2O) | |
| C. | A点与B点相比:2n(NH4+)>n(NH4+) | |
| D. | 从C到D的过程中,可能出现:c(Cl-)>c(NH4+) |
20.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 用玻璃棒蘸取浓硫酸点到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| C | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
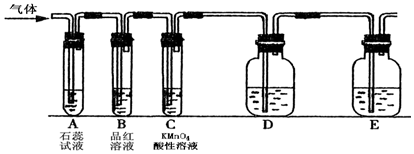
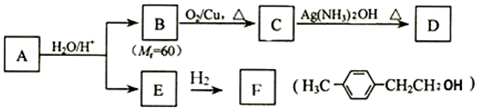
 .
. (其中一种).
(其中一种). )的合成路线.
)的合成路线.